Ibuprofène,
techniques chromatographiques
Concours externe technicien police technique et scientifique 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice 1. pH.
La molécule d'ibuprofène a pour formule : 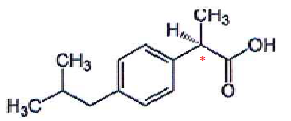
C'est un acide faible noté RCOOH, de pKa = 4,5.
1. Combien de carbone asymétrique possède-t-elle ? Identifier les ? Conclure.
La molécule compte un atome de carbone asymétrique repéré par *. Il existe donc deux énantiomères.
2. Le pH du sang est d'environ 7. Quel est le rapport entre la concentration de la base RCOO- et celle de l'acide conjugué dans le sang ?
pH = pKa + log ([RCOO-] / [RCOOH]) ; log ([RCOO--] / [RCOOH])= pH - pKa =7-4,5 = 2,5.
([RCOO--] / [RCOOH] = 102,5 ~316.
3. pH d'une ssolution d'ibuprofène à 0,1 M.
a. Ecrire les différents équilibres chimiques qui s'établissent dans cette solution aqueuse.
RCOOH + H2O = RCOO- + H3O+.
2H2O = H3O+ +HO-.
b. Calculer le pH de cette solution.
|
Avancement volumique
|
RCOOH
|
+ H2O |
= RCOO- |
+ H3O+ |
Initial
|
0
|
0,1
|
Solvant
|
0
|
0
|
à l'équilibre
|
x
|
0,1-x
|
x
|
x
|
Ka = 10-4,5 = 3,16 10-5 = x2 /(0,1-x).
x2 + 3,16 10-5 x - 3,16 10-6 =0.
D =( 3,16 10-5 )2 +4*3,16 10-6 =1,264 10-5 ; D½ =3,555 10-3.
x =( 3,16 10-5 +3,555 10-3 )/2=1,79 10-3.
pH = - log (1,79 10-3) = 2,75.
4. On dose la solution d'ibuprofène par la soude..
a. Ecrire l'équation de la réaction qui se produit entre la soude et l'ibuprofène.
RCOOH aq + HO- aq ---> RCOO-aq +H2O(l).
b.
Calculer la valeur de la constante d'équilibre de cette réaction et
vérifier que cette réaction peut être considérée comme totale.
K = [RCOO-aq] / ([RCOOH aq] [HO- aq] =Ka / Ke = 10-4,5 / 10-14 =109,5 ~ 3,16 109.
K est très grand, la réaction est totale.
c. On souhaite
suivre le dosage par pHmétrie, d'un point de vue pratique, quel type
délectrodes utiliseriez-vous pour mesurer le pH de la solution ?
Electrode combinée ( électrode de verre ( pour la mesure du pH) et une électrode au calomel saturée ( référence)).
d. Une solution contient un mélange d'ibuprofène et de kétoprofène ( pKa = 4,6 à 298 K). On dose ce mélange par une solution de soude. Les deux composés seront-ils dosés séparément par la soude ?
Non, les pKa des deux couples acide / base sont trop proches l'un de l'autre.
Exercice 2, analyses chromatographiques.
Partie 1 : chromatographie en phase gazeuse.
L'ibuprofène peut être détecté par chromatographie en phase gazeuse muni d'un détecteur à ionisation de flamme ( CG/FID).
1. Rappeler brièvement le principe de la chromatographie gazeuse.
Un
fluide appelé phase mobile parcourt un tube appelé colonne. Cette
colonne peut contenir des "granulés" poreux (colonne remplie) ou être
recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les
deux cas, la colonne est appelée phase stationnaire.
A
l'instant initial, le mélange à séparer est injecté à l'entrée de la
colonne où il se dilue dans la phase mobile qui l'entraîne à travers la
colonne. Si la phase stationnaire a été bien choisie, les constituants
du mélange, appelés généralement les solutés, sont inégalement retenus
lors de la traversée de la colonne.
De
ce phénomène appelé rétention il résulte que les constituants du
mélange injecté se déplacent tous moins vite que la phase mobile et que
leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de
la colonne les uns après les autres et donc séparés.
Un
détecteur placé à la sortie de la colonne couplé à un enregistreur
permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige
sur un enregistreur un signal constant appelé ligne de base en présence
du fluide porteur seul ; au passage de chaque soluté séparé il conduit
dans le temps à l'enregistrement d'un pic.
2.a. Quelles sont les caractéristiques de ces gaz pour ne pas endommager la colonne ?
Le
gaz vecteur doit être pur, inerte (il ne doit pas réagir avec les
constituants de l'échantillon à séparer) et non miscible avec la phase
stationnaire.
2.b.
Dans la théorie des plateaux, que représente H ( appelé aussi HEPT).
Comment évolue l'efficacité d'une colonne en fonction de H ?
Une colonne à N plateaux théoriques est une colonne divisée en N petits
disques successifs ; elle se comporte comme une colonne à distiller de
N plateaux. La phase mobile progresse par sauts successifs d'un
plateau à un autre. Dans chaque plateau on observe une rétention du
soluté.
La hauteur équivalente à un plateau théorique estégale à H = L / N, indépendant de la longueur de la colonne.
Une
bonne colonne à chromatographie donne des pics fins pour des temps de
rétention élevés. Le nombre de plateaux théoriques est grand. Plus H
est petit, plus la colonne est efficace.
2.c. Justifier le choix de l'hydrogène comme gaz vecteur.
Allure des courbes de Van Deemter : 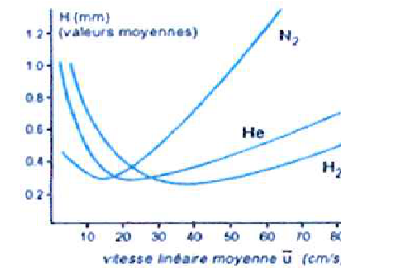
Le minimum des courbes pour He et H2 sont larges et se
produisent pour des débits plus élevés, ce qui signifie une analyse
plus rapide. He, non inflammable est souvant préféré à H2.
3. Définir
le temps mort. Calculer le temps mort puis estimer le temps de
rétention réduit de l'ibuprofène. Colonne Rtx-5 ( 30 m x 0,25 mm x 0,5
µm ). Injecteur de type split. Ratio de split 1 : 10. Volume injecté
: 2 µL. Gaz vecteur : hydrogène 0,6 mL / min.
Le temps mort, noté tM ou t0 est le temps que met
un soluté non retenu ( l'air dans le cas de la CPG ) à sortir de
la colonne. En HPLC, c'est le temps mis par la phase mobile pour
traverser la colonne.
Temps de tétention réduit : l'origine est le pic du temps mort et non pas le moment de l'injection.
On note u la vitesse linéaire ( m / s) de la phase mobile dans la
colonne , D le débit , L la longueur de la colonne et r son rayon.
D =pr2L / t et u = L / t ; u =D / (pr2).
D = 0,6 10-6 / 60 = 1,0 10-8 m3 s-1 ; r = 0,125 mm = 1,25 10-4 m.
u = 1,0 10-8 / (3,14 *(1,25 10-4)2) =0,2037 m /s.
tm = L / u = 30 / 0,2037 ~147,3 s ou 2,5 min.
tR ~7 min , temps de rétention réduit 7-2,5 ~4,5 min.
4. Que signifie " ratio de split : 1 / 10" ?
Coefficient de fractionnement 1 / 10 : l'échantillon injecté est divisé
en 10 parties et une seule entrera dans la colonne capilaire : on
minimise la charge de la colonne.
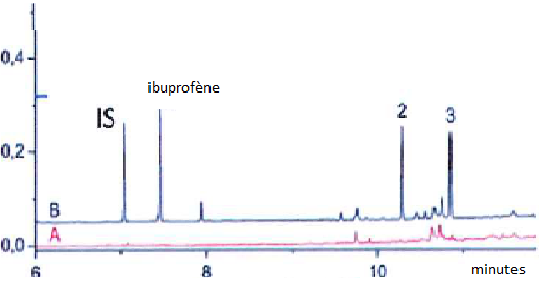
3.
La teneur en ibuprofène est déterminée par la méthode de l'étalon
interne. L'étalon interne en question est l'acide
3-(4-chlorophényl)propionique ( noté IS sur le chromatogramme) .
Expliquer en quoi consiste cette méthode. Comment se fait le choix de
l'étalon interne ?
On compare les surfaces des pics du mélange avec un étalon servant de référence.
Premier chromatogramme
: les concentrations sont connues en élléments à doser auquel on ajoute
l'étalon. On détermine les coefficients de proportionnalité.
me = ke Ae ; m1 = k1 A1 ; m2 = k2 A2
m1 / me = k1 /ke A1 / Ae.
Second chromatogramme
: on ajoute un volume connu d'étalon au mélange à analyser. Le
chromatogramme permet d'en déduire les fractions massiques du mélange.
m'i / m'e = ki /ke A'i / A'e.
L'étalon interne doit être bien séparé des autres pics ; son temps de
rétention et sa concentration doivent être proches de ceux des
élléments dosés ; il nne doit pas réagir avec les constituants du
mélange.
|
|
|
Partie 2 : chromatographie en phase liquide.
L'ibuprofène
peut être aussi détecté par HPLC. Les conditions chromatographiques
sont les suivantes : colonne "chromolith RP18 qui est une phase
stationnaire en silice greffée C18 4,6 x 250 mm , 5µm. Phase
mobile : 70 % d'eau contenant 0,1 % d'acide phosphorique et 30 %
d'acétonitrile. Débit : 1 mL / min ; détecteur UV à 254 nm. On
obtient un chromatogramme dont les caractéristiques sont les suivantes
:
N° du pic
|
Nom
|
tR en min
|
Largeur à mi-hauteur du pic ( d en min)
|
1
|
kétoprofène
|
2,050
|
0,074
|
2
|
fenoprofène
|
2,790
|
0,049
|
3
|
fluubiprofène
|
2,938
|
0,037
|
4
|
ibuprofène
|
3,235
|
0,074. |
1. Rappeler en 3 lignes maximum, le principe de l'HPLC.
L'échantillon
à analyser est poussé par une phase liquide dans une colonne contenant
une phase fixe, constituée de grains de très petite taille, ce qui
permet une meilleure séparation des composants.
Le débit de la phase mobile étant elevé, la pression
augmente dans le système. Souvent la composition de la phase mobile est
modifiée au cours de l'analyse ( mode "gradient").
2. La colonne C18 greffée est-elle polaire ou apolaire ?
Les groupes alkyles greffés sur la phase stationnaire comptent 18 atomes de carbone. La colonne est apolaire.
3. Que représentent les valeurs indiquées pour la colonne : 4,6 x 250 mm ,5 µm ?
4,6 mm, diamètre interne ; 250 mm : longueur ; 5 µm : granulométrie.
4. Citez trois type de détedteurs utilisés en HPLC
Détecteur UV, Réfractomètre ; spectromètre de masse ; conductimètre.
5. Pourquoi travaille-t-on avec un éluant à pH acide ( pH< 3,5) ?
Les composés cités dans le tableau sont des acides carboxyliques de pKa voisin de 4,5.
A pH inférieur à pKa-1, la forme acide prédomine.
6. A partir des donnés du pic n° 4, calculer le nombre de plateaux théoriques.
N = 5,54(tR / w½)2 =5,54 (3,235 / 0,074)2~10588.
7. Calculer le facteur de résolution Rs des pics 2 et 3. Sont-ils bien résolus ?
Rs= 2[(tR(3)-tR(2) ] / (w3+w2) avec w3 =1,7*0,037=0,0629 et w2 =1,7*0,049=0,0833.
Rs= 2(2,938-2,790) / (0,0629 +0,0833)=1,0, valeur inférieure à 1,5 : les pics ne sont pas correctement séparés.
8. En vue d'augmenter le facteur de résolution entre les pics 2 et 3 quelle(s) est /sont la /les propositions correctes ?
a. augmenter le % d'acétonitrile de la phase éluante ;
(on augmente la polarité de la phase mobile )
b. augmenter le débit ;
Le temps de rétention est proportiennel au débit.
c. diminuer le % d'acétonitrile de la phase éluante. (vrai ).
(on diminue la polarité de la phase mobile, donc son pouvoir éluant ; les temps de rétention augmentent )
|
|
|
|
Exercice 3 : statistiques pour chimiste.
Dans
le cadre de la quantification d'un produit dopant A dans les urines des
sportifs, un test à blanc a été réalisé sur n = 4 échantillons.
Concentration estimée de A ( µg/L)
|
0,5
|
1
|
1,4
|
1,9
|
1. Déterminer la moyenne de ce test blanc. On considèrera que l'écart type est une bonne estimation de DX.
Xmoyen = (0,5 +1 +1,4 +1,9) / 4 =1,2 µg/L.
Variance : V = [(0,5-1,2)2 + (1-1,2)2 + (1,4-1,2)2 + (1,9-1,2)2] / 4 =(0,49 + 0,04+ 0,04 +0,49 ) / 4 =0,265.
Ecart type : 0,265½=0,514 ~0,5.
Xmoyen = 1,2 ±0,5 µg / L.
On exprime historiquement les limites de détection ( LOD) et de
quantification ( LOQ) comme étant égales à resppectivement 3 et 10 fois
la valeur de l'écart type sur le blanc augmentée de la valeur moyenne
du blanc.
2. Définir ce que représentent LOD et LOQ puis calculer ces valeurs.
LOD : plus faible concentration d'une espèce chimique que l'on peut trouver dans un échantillon.
3 *0,5 +1,2 = 2,7 µg/L.
LOQ : plus faible concentration d'un produit à analyser dans un
échantillon que l'on peut quantifier avec une précision et une
exactitude acceptable dans des conditions expérimentales précisées.
10*0,5+1,2 = 6,2 µg/L.
3. On
procède à la mesure de deux échantillons suspects. Le premier résultat
donne une valeur de 2,5 µg/L et le second de 6 µg/L. Commentez
ces résultats.
2,5 est inférieure à la LOD mais proche et 6 est inférieure à la LOQ mais proche.
Il faudrait augmenter le nombre de mesures afin d'amliorer le seuil de détection et de quantification.
On risque de conclure à la présence de la substance recherchée alors qu'elle est absente, ou l'inverse.
4. Attribuer à chacune des cibles le bon terme : justesse, fidélité, exactitude.
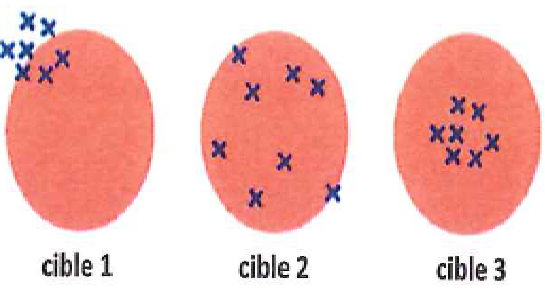
Exactitude : bon accord entre le résultat expérimental et une valeur de référence.
Justesse : bon accord entre la valeur moyenne obtenue à partir d'une grande série d'essais et une valeur de référence.
Fidélité : faible dispersion des résultats.
Cible 3. Fidélité et exactitude.
Cible 1 : fidèle et inexact.
Cible 2 : juste, mais pas fidèle.
5. Définir les termes suivants :
Répétabilité : mesure de la fidélité lorsque les mesures sont faites par un même opérateur, sur un même instrument et dans un délai court.
Reproductibilité : mesure de la fidélité lorsque n'importe quelle condition change ( opérateur, instrument, délai d'exécution ...).
|
|