Elaboration du vin
de Champagne, les fermentations.
Concours général SPCL 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Première fermentation.
1. Ecrire l'équation chimique de la
réaction rendant compte de la première fermentation.
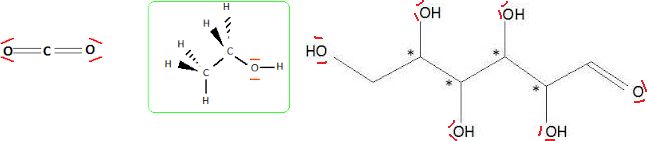
C6H12O6
---> 2C2H6O + 2CO2(g)
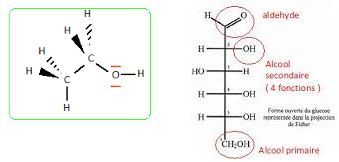
2. Représenter les formules
semi-développées, assorties des doublets non liants, de l'ensemble des
réactifs et des produits de cette réaction.
3. Pour les
molécules organiques, identifier les groupes caractéristiques et nommer
les familles correspondantes.
HO : groupe hydroxy ; CO : groupe carbonyl.
4. Le nom éthanol
est-il conforme à la nomenclature systématique de l'espèce chimique
concernée ? Justifier ce nom. Donner en nomenclature systématique le
nom du glucose.
Ethanol : la chaine carbonée compte deux atomes de carbone et il s'agit
d'un alcool ( terminaison "e" remplacée par "ol".
Glucose : 2, 3, 4, 5, 6-pentahydroxyhexanal.
Lors de cette première fermentation, la quantité importante de CO2
formé est source de danger pour les viticulteurs travaillant dans les
caves. Ils peuvent mettre en place un système de ventilation régulée
grâce à un détecteur électronique de CO2.
5. Compléter le schéma ci-dessous.
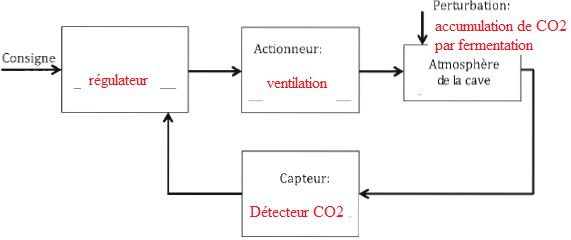
6. Identifier les deux flèches qui
correspondent à un signal électrique ( courant continu d'intensité
comprise entre 4 et 20 mA.
Flèches entre le capteur et le régulateur et entre le régulateur et
l'actionneur.
7. Proposer et décrire une consigne
à appliquer sachant que l'on utilisera une régulation à action
discontinue (TOR) à deux seuils de basculement.
Mesurer la teneur en CO2 avec
le capteur.
Le régulateur compare la valeur réglée avec la consigne et élabore le
signal de commande.
Dès que la teneur en CO2 atteint 1%, mettre en route la
ventilation. Couper celle-ci dès que la teneur en CO2
atteint 0,1 %.
8. Tracer
qualitativement l'évolution de la valeur du taux de CO2 dans
l'atmosphère de la cave si la ventilation est régulée selon la consigne
décrite.
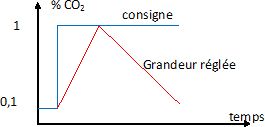
9. Ce système de
régulation est-il stable ou instable ?
La mesure n'est pas constante dans le fonctionnement TOR. Le système
est dans un état d'instabilité entretenue.
|
|
|
Seconde fermentation ou prise de mousse.
La fermentation alcoolique se poursuit dans une bouteille scéllée.
Vin de base : 2 g /L de sucre, 11° d'alcool, concentration en CO2 négligeable.
Prise de mousse : on scelle dans une bouteille de 75 cL :
73 cL de vin de base ; 2 cL de liqueur de tirage ( 850 g de sucre par litre + levures) ; 2,5 cL d'air.
Vin après prise de mousse : 3 g/L de sucre résiduel ; volume de liquide 75 cL ; volume de gaz 2,5 cL.
10. Déterminer la quantité de matière de sucre ajoutée lors de la prise de mousse.
2 cL contient m =850 *2 /100 = 17 g de glucose soit n =m /M(glucose) = 17/180 =0,0944 mol.
11. Déterminer la quantité de matière de sucre consommée par la fermentation alcoolique pendant la prise de mousse.
Il reste (3-2) *75/100 =0,75 g de glucose ajouté dans la bouteille.
17-0,75 = 16,25 g de glucose ajouté et consommé ; 16,25 / 180 = 0,0903
mol.
12. Estimer la valeur du degré d'alcool du champagne après la prise de mousse.
n( éthanol) formé = 2 n(glucose) consommé = 2*0,0903 = 0,181 mol.
Masse correspondante : m = 0,181 M (éthanol) = 0,181 *46 = 8,3 g.
Volume d'alcool correspondant : m / masse volumique éthanol = 8,3 / 0,79 = 10,5 mL~ 1 cL
Augmentation du degré alcoolique : 1,05 / 75 *100 = 1,4°.
Degré d'alcool du champagne : 11+1,4 = 12,4 °.
13. La masse de
sang chez un être humain représente environ 8 % de sa masse corporelle.
En considérant que tout l'alcool ingéré passe dans le sang, estimer
l'alcoolémie ( en g / L) atteinte pour une femme de 60 kg ayant bu une
coupe de champagne de 10 cL. Commenter cette valeur.
Masse de sang : 60*0,08 =4,8 kg soit environ 5 L de sang.
Volume d'alcool dans la coupe : 1,24 cL = 12,4 mL soit 12,4*0,79 ~9,8 g.
Alcoolémie : 9,8 / 5 ~2,0 g/L. La conduite d'une voiture est impossible.
14. En réalité,
seule une fraction de l'alcool passe dans le sang. Il faut multiplier
le résultat précédent par 0,134. Estimer le nombre de coupe que cette
femme peut boire avant de conduire un véhicule. L'alcoolémie doit rester inférieure à 0,5 g /L.
2,0 *0,134 ~0,26 g/L ; 0,5 / 0,26 ~2 coupes.
15. Grâce à la loi
de Henry, et en considérant le dioxyde de carbone comme un gaz parfait,
établir la relation liant la quantité de matière ng de CO2 contenue dans 2,5 cL de gaz au dessus du liquide et la quantité de matière naq de CO2 dissoute dans le champagne.
La concentration C du dioxyde de carbone en solution, en équilibre avec
une atmosphère contenant ce gaz est proportionnelle à la pression
partielle PCO2 de ce gaz : PCO2 = KH C.
KH = 3000 Pa mol-1 m3 à 20°C.
PCO2 = ng RT / V =ng (8,314*293) / (2,5 10-5)=9,74 107 ng avec PCO2 en Pascal.
naq = C *75 10-5 =7,5 10-4 C =7,5 10-4 PCO2 / KH avec C en mol m-3.
naq =7,5 10-4 *9,74 107 ng / 3000 ; naq =24,3 ng.
16. En déduire la concentration molaire en dioxyde de carbone dans le champagne et la pression du gaz de la bouteille.
nCO2 total =n éthanol formé = 0,181 mol.
naq +ng = 0,181 ; (1+24,35)ng = 0,181 ; ng = 7,14 10-3 mol.
naq = 24,35 *7,14 10-3 =0,174 mol.
C = 0,174 / (7,5 10-4) =2,32 102 mol m-3.
PCO2 =3000*2,32 102 =6,9 105 Pa.
17. L'étape
suivante qui suit la prise de mousse est le dégorgement. On expulse les
levures par le goulot grâce à la surpression. La totalité du CO2 présent dans le gaz de la bouteille est perdue. Après
le dégorgement, on scelle à nouveau la bouteille. Déterminer la
nouvelle pression du gaz de la bouteille après cette étape.
naq +ng = 0,174 mol.
(1+24,35)ng = 0,174 ; ng = 6,86 10-3 mol ; naq = 24,35 *6,86 10-3 =0,167 mol.
C = 0,167 / (7,5 10-4) =2,23 102 mol m-3.
PCO2 =3000*2,23 102 =6,7 105 Pa
|
|
|
|
La fermentation malo-lactique permet de réduire l'acidité d'un vin.
Elle met en jeu la transformation de l'acide malique C4H6O5 en acide lactique C3H6O3.
18. Expliquer pourquoi cette transformation réduit l'acidité du vin.
C4H6O5 --> C3H6O3 +CO2(aq)
L'acide malique est un diacide faible de pKa 3,5 et 5,1. L'acide lactique est un monoacide faible de pKa= 3,9.
La consommation de 1 g/L d'acide malique fait chuter l'acidité du vin de 0,4 g/L d'H2SO4.
On
peut suivre la fermentation grâce à une chromatographie sur papier
Whatman, constitué de cellulose. L'éluant est un mélange butanol /
acide éthanoïque. La cellulose contient des groupes -OH et des ponts
C-O-C capables de mettre en jeu des interactions hydrogène. PLus un
composé va pouvoir établir des interactions hydrogène avec la
cellulose, moins il va migrer.
19. Décrire succinctement et schématiser le protocole de réalisation d'une analyse chromatographique.
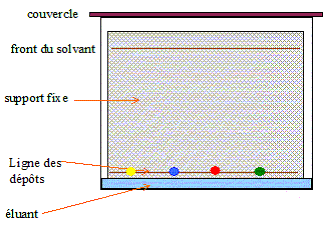
Tracer
au crayon à papier une ligne à un peu plus de 1 cm du bas de la plaque
. Mrquer au crayon sur cette ligne les emplacements où l'on déposera
les solutions à analyser. Les emplacements doivent être distants
d'environ 1 cm, et à au moins 1 cm des bords.
Dépôt de l'échantillon :
A l'aide d'une pipette pasteur, ou d'un tube capillaire, déposer une
goutte sur la plaque à l'emplacement marqué. Laisser sécher. Si la
solution est trop diluée, on peut faire plusieurs dépôts au même
emplacement , à condition de bien sécher la plaque entre deux gouttes.
Développement du chromatogramme :
Lorsque les dépôts sont secs, placer la plaque le plus verticalement
possible dans la cuve, ligne de dépôt vers le bas. La surface de
l'éluant doit être en de cette ligne. Couvrir. Surveiller la plaque
régulièrement : quand l'éluant est à environ 1 cm du bord supérieur,
sortir la plaque, marquer le niveau atteint par le solvant au crayon à
papier, sécher la plaque.
Révélation :
Si les taches sont incolores, on les fera apparaître sous une lampe UV ou à l'aide d'un chimique.
Par exemple les fonctions alcool des sucres réduisent le permangante de potassium qui vire au jaune.
20. Indiquer les sites des
acides malique, lactique, tartrique et succinique susceptibles
d'établir des interactions hydrogène avec la cellulose.
Groupe hydroxy -OH et groupe carboxyle -COOH.
21, 22 et 26. Décrire le chromatogramme obtenu. Identifier les taches.
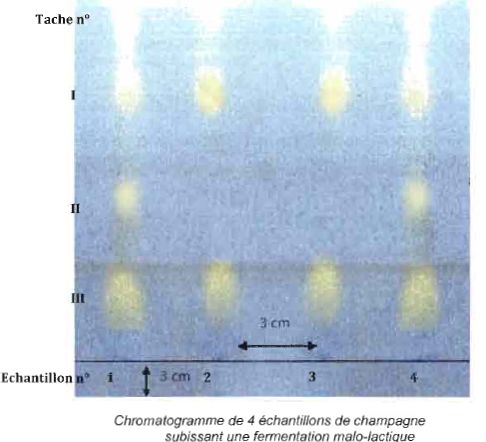
Les échantillons 1 et 4 présentent la tache n°II, sans doute celle correspondant à l'acide malique.
Tous les échantillons présentent les taches n°I et III. La tache n°I
est plus intense dans les échantillons 2 et 3, dans lesquelles la
fermentation malo-lactique est terminée. I correspond à l'acide
lactique. II correspond aux acide succinique et tartrique, mal séparés.
Le révélateur est
un indicateur coloré : le bleu de bromophénol. Il est pulvérisé sous sa
forme basique bleue.. On donne le diagramme de prédominance du bleu de
bromophénol.
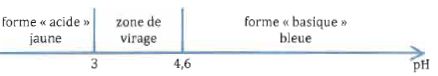
23. Le pH du
champagne est légérement inférieur à 3. Déterminer la forme
prédominante des acides lactique, malique, tartrique et succinique dans
le dépôt.
A pH inférieur à pKa, les acides prédominent sous la forme R-COOH.
24. Justifier le choix du bleu de bromophénol.
Le bromophénol pulvérisé est sous forme basique bleue. Le pH du
champagne correspond à la limite inférieure de la zone de virage de cet
indicateur coloré de pH. En présence des acides contenus dans les
taches du chromatogramme, cet indicateur va virer au jaune, mettant en
évidence les taches sur fond bleu.
25. Justifier le choix de l'acide éthanoïque comme composant du mélange.
L' acide acétique est polaire ( pKa = 4,8) ; les 4 acides
cités sont polaires, donc solubles dans l'acide acétique. L'autre
composant du mélange, le butanol est moins polaire, mais son squelette
carboné présente une affinité pour la chaine carbonée des 4 acides
cités.
|
|
|
|