Dosage
du
glucose dans une eau aromatisée.
Concours Geipi Polytech 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Le
glucose est un sucre d’origine naturelle, abondamment utilisé dans
l’industrie alimentaire. Il est
mis en oeuvre par certains producteurs d’eau embouteillée dans la
fabrication de produits «aromatisés», dont la concentration massique en
glucose est typiquement de plusieurs
grammes par litre.
Une forme de la molécule de glucose est représentée ci-dessous :
II-1-
Donner la formule brute du glucose. C6H12O6.
II-2-a
Marquer d’une étoile le ou les atome(s) de carbone asymétrique(s).
II-2-b
Entourer deux types de fonctions chimiques présentes dans la molécule
et les nommer.
II-2-c
Faire apparaître les doublets non liants sur chacun des atomes qui en
porte.
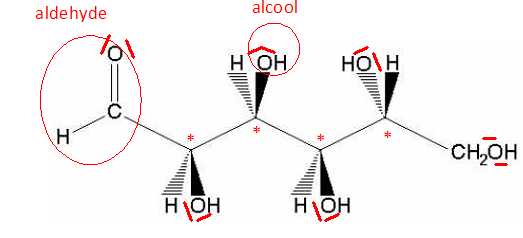
L’analyse consistera à doser le glucose présent dans une eau minérale aromatisée.
On
procède dans un premier temps à l’oxydation complète du glucose (nommé
RCOH) de l’échantillon par un excès de diiode, selon la réaction :
RCOH + I2 (aq) + 3 HO- --> RCOO- (aq) + 2 I- (aq) + 2 H2O.
II-3- Indiquez les deux couples Oxydant / Réducteur mis en jeu au cours de la réaction.
RCOO- (aq) /RCOH et I2 (aq) / I- (aq). On introduit dans une fiole jaugée une prise d’essai de 50,0 mL d’eau minérale aromatisée à
laquelle est additionnée 25,0 mL d’une solution de diiode de concentration 0,10 mol.L-1 ; le
volume de la solution est ensuite complété par de l’eau pure jusqu’à 100,0 mL.
II-4- Calculer la quantité de matière de diiode mis en oeuvre pour effectuer l'analyse.
n(I2) =0,10 *25,0 = 2,5 mmol.
Pour suivre l'évolution temporelles de la solution, des prélèvements sont effectués toutes les 5
minutes et placés dans une cuve de spectrophotométrie en quartz de profondeur l = 10,0 mm.
L’absorbance du diiode de la solution est suivie par spectrophotométrie à la longueur d’onde
l0 = 320 nm.
II-5- Dans quel domaine de rayonnement les mesures ont-elles été effectuées?
Ultraviolet.
|
|
|
La courbe d’étalonnage ci-dessous, établie préalablement, permet de corréler l’absorbance à la
concentration en diiode d’une solution.
II-6- Déterminer le coefficient d'absorption molaire du diiode (loi de Beer-Lambert).
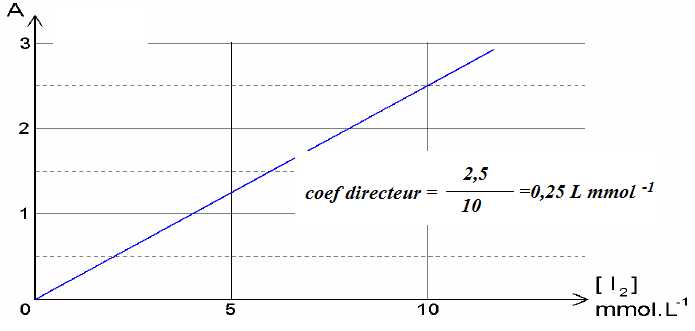
0,25 L mmol-1 =0,25 m3 mol-1 ; 0,25 = e l [I2] avec l =1,00 10-2 m.
e = 25 m2 mol-1.
|
|
|
|
II-7- Donner l’allure de l’évolution de l’absorbance de la solution au cours du temps.
L'absorbance et la concentration en diiode sont proportionnelles.
A = 0,25 [I2] avec [I2] en mmol/L.
[I2] diminue au cours du temps et se stabilise, le diode étant en excès. L'absorbance diminue au cours du temps.
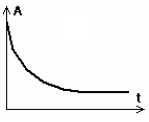
Lorsque
la valeur de l’absorbance n’évolue plus, on déduit de la mesure de
l'absorbance A la concentration de diiode de la solution :
[I2]finale = 2,8*10-3 mol.L-1 puis la quantité de diiode consommée au cours de la réaction : n(I2 consommé) = 2,22*10-3 mol.
II-8-
Déterminer, à partir de ces résultats expérimentaux, la quantité de
matière de glucose présente dans l’échantillon d’eau aromatisée.
RCOH + I2 (aq) + 3 HO- --> RCOO- (aq) + 2 I- (aq) + 2 H2O.
n(glucose) = n(I2 consommé) =2,22*10-3 mol dans 50,0 mLd'eau aromatisée.
II-9- En déduire la concentration massique de glucose dans l’eau aromatisée analysée.
Données : M(glucose) = 180 g.mol-1.
[glucose]= 2,22*10-3 / (50,0 10-3)=4,44 10-2 mol/L.
Concentration massique : 4,44 10-2 *180 = 7,99 g / L.
|
|