RMN du
5-hydroxyméthylfurfural .
Concours assistant d'ingénieur Maine 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Spectre RMN du
5-hydroxyméthylfurfural ( HMF).
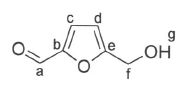
Son spectre RMN1H réalisé dans CD2Cl2
présente les signaux suivants :
- un singulet à 2,8 ppm d'intégration 1H ( aspect de massif large) qui
disparaît si on réalise le spectre en présence d'un composé protique
deutéré tel que D2O ;
- un singulet à 4,7 ppm d'intégration 2H ;
- un singulet à 5,3 ppm ;
- deux doublets à 6,5 et 7,2 ppm d'intégration 1 H chacun ;
- un singulet à 9,6 ppm d'intégration 1 H.
1. Que veut dire
TMS et quel est son rôle.
Tétraméthylsilane
Si(CH3)4.
Pour apprécier le blindage subit par un proton, il faut une référence.
Les
12 protons équivalents du TMS présentent une absorption intense à des
champs plus forts que dans la plupart des autres protons. Le pic
correspondant est bien séparé à droite de l'enregistrement.
2. A quoi correspond le signal à
5,3 ppm ?
Proton résultant d'un équilibre
céto-énolique.
3. Sachant que le
spectre a été enregistré à 200 MHz, convertir les valeurs des
déplacements chimiques, donnés en ppm, en hertz.
Déplacement
chimique en ppm
|
2,8
|
4,7
|
6,5
|
7,2
|
9,6
|
Déplacement
chimique en hertz
|
560
|
940
|
1300
|
1440
|
1920
|
1 ppm correspond à 200 Hz.
4. Quels seraient
les déplacements chimiques, exprimés en ppm, si le spectre avait été
enregistré à la fréquence de 360 MHz ?
560 / (360 106) = 1,55 10-6 ~ 1,6 ppm.
940
/ (360 106) = 2,61 10-6 = 2,6 ppm.
1300 / (360 106) = 2,32 10-6
= 2,3 ppm.
1440 / (360 106) = 4,0 10-6
= 4,0 ppm.
1920 / (360 106) = 5,33 10-6
= 5,3 ppm.
|
|
|
5.
Pourquoi le signal à 2,8 ppm disparaît-il en présence d'un composé
protique deutéré ?
Les
hydrogènes échangeables ne sont pas liés de manière stable à une
molécule ; ils sont en équilibre avec les hydrogènes du solvant. Les
protons liés à des groupes amines et hydroxy sont des protons
échangeables.
6. Attribuer les signaux aux
différents protons.
f : singulet à 4,7 ppm d'intégration 2H ;
c et d : deux
doublets à 6,5 (c) et 7,2 ppm (d , plus proche de l'aldehyde, plus
déblindé ) d'intégration 1 H chacun ;
a : singulet à 9,6 ppm d'intégration 1 H.
7. Justifier le
couplage des signaux à 6,5 et 7,2 ppm.
Les protons éthyléniques ne sont pas équivalents du fait de l'absence
de libre rotation autour de la double liaison C=C; ces protons sont de
plus en position de couplage..
8. Les atomes
d'hydrogène éthyléniques présentent des déplacements chimiques
usuellement plus bas. Quelle peut être l'origine des valeurs élevées
observées ici ?
Le cycle furanique à 5 atomes, dont un atome d'oxygène et deux doubles
liaisons, présente un caractère aromatique. La circulation des
électrons p a
pour effet de déblinder les atomes d'hydrogène lié au cycle aromatique.
|
|
|
|
L'analyse
par spectroscopie RMN du carbone 13 du HMF permet d'observer les pics
suivan,ts :
Déplacements chimiques en ppm : 57,5 ; 110,1 ; 122,7 ; 151,2 ;
160,7 ; 177,3.
9. Attribuer chaque
signal du spectre au carbone correspondant.
a : 177,3 ; b : 160,7 ; c : 122,7 ; d : 110,1 ; e : 151,2 ; f :
57,5 ;
10. Le spectre RMN 13C
du HMF sera t-il modifié par une séquence DEPT 135 ? Si oui comment ?
Le spectre DEP permet de différencier les carbones selon leur
hydrogénation.
Dans une séquence DEPT 135, les carbones non hydrogénés sont absents,
les CH2 inversés, les CH et CH3 inchangés.
11. Que signifie
l'acronyme NOE ?
Effet overhauser nucléaire.
12. Quelle est la
différence entre un spectre RMN 2D COSY et RMN 2D NOESY ?
La RMN 2D COSY met en évidence les protons couplés de façon scalaire.
La RMN 2D NOESY :
effet NOE : changement d'intensité de deux signaux de deux noyaux en
interaction dipolaire. Cet effet est inversement proportionnel à la
distance entre les noyaux.
Le monomère du 5-hydroxyméthyl-2-vinylfuranne, représenté ci-dessous,
peut être synthétisé à partir du HMF.
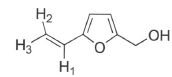
13. Que veut dire
le terme monomère ?
Substance utilisée dans la synthèse des polymères. Un monomère possède
une ou plusieurs fonctions chimiques susceptibles de participer à une
réaction de polymérisation.
On s'intéresse à l'analyse RMN 1H des signaux
caractéristiques des protons H1, H2 et H3
de la fonction alcène.
Déplacement
chimique ( ppm)
|
Valeur
intégration
|
Multiplicité
|
Constante
de couplage ( Hz)
|
5,11
|
1
|
dd
|
3J
=11,30 ; 2J =1,50
|
5,58
|
1
|
dd
|
3J
=17,50 ; 2J =1,50 |
6,53
|
1
|
dd
|
3J
=17,50 ; 3J =11,30 |
14. Attribuer les
signaux à 5,11, 5,58 et 6,53 ppm.
d = 5,28 +sgem+scis+strans.
Pour un cycle aromatique : sgem = 1,35 ; scis =0,37 ; strans =-0,10.
d H1 : 5,28 +1,35=6,63 ; d H2 : 5,28 +0,37 =5,65 ; d H3 : 5,28 -0,10=5,18.
15. Expliciter la multiplicité du signal à 5,11 ppm.
Les protons H1 et H2 ne sont pas équivalents du
fait de la rigidité de la double liaison C=C. Chaque proton possède
donc deux protons proches voisins non identiques, d'où un doublet de
doublet.
16. Que signifie le nombre 3 du symbole 3J ?
2J désigne un coulage geminal et 3J
17. Le spectre RMN du proton a été enregistré à 300 MHz. Représenter le
signal observé à 5,58 ppm.
1,50 / 300 =0,005 ppm ; 17,50 /300 = 0,058 ppm.

|
|
|
|