Chimie générale.
Concours assistant d'ingénieur Maine 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice 1.
Une demi-pile est constituée d'une électrode de cuivre immergée dans 50
mL d'une solution de sulfate de cuivre à 8 10-3 mol/L.
a. Quel est le
potentiel de cette électrode à 25°C ?
E = E°(Cu2+aq/Cu(s) +0,03 log [Cu2+ aq] =0,34
+0,03log(8 10-3)=0,277 ~0,28
V.
b.
On ajoute 0,05 mol de NH3 à la solution ci-dessus ; il se
forme Cu(NH3)42+. De combien varie le
potentiel de l'électrode ? Constante de formation du complexe Kf
= 3,9 1012.
Hypothèse : [NH3aq]
~constante ~0,05 /0,05 ~1 mol/L. [Cu(NH3)42+aq] ~8 10-3
/0,050~0,16 mol/L.
Kf
=[Cu(NH3)42+aq] /([NH3aq]4[Cu2+aq])
; [Cu2+aq]
=0,16 /(3,9
1012)~4 10-14
mol/L
E' =0,34 +0,03 log(4 10-14 )
~ -0,062 V.
E'-E ~-0,062 -0,277 ~ -0,34 V.
Exercice 2.
On dispose de 4 flacons scellés à l'abri de la lumière contenant
respectivement.
a) une solution d'hypochlorite de sodium à 0,1 mol/L ;
b) une solution de soude à 10-3 mol/L ;
c) une solution d'hydrogénophosphate de sodium à 0,1 mol/L ;
d) une solution de quinine à 10-3 mol/L.
Les flacons portent pour toute indication que le pH de la solution
qu'ils contiennent.
| Flacon |
01 |
2 |
3 |
4 |
| pH |
9,80 |
10,25 |
9,52 |
11 |
Déterminer
les solutions qui remplissent chaque flacon.
Soude : pH
= 14 + log c = 14+log 10-3 = 11.
Hypochlorite de
sodium , base faible : pKa(HClO / ClO-)
=7,5.
pH =7+½pKa+½log c =7+3,75 -0,05 = 10,25.
Hydrogénophosphate de sodium
: pKa2(H2PO4- / HPO42-)
=7,2 ; pKa3(HPO42-
/PO43-) =12,4.
pH
=½pKa2+½pKa3 =(7,2+12,4) / 2 = 9,8.
Quinine :
dibase de pka respectifs 8,04 et 4,03.
Exercice 3.
L'objectif est de constituer une solution tampon de pH = 4,9 et de
volume 500 mL.
a. Quelles sont les
propriétés d'une solution tampon ?
Une solution tampon modère les variations de pH lors de l'ajout modéré
d'un acide ou d'une base et lors d'une dilution modérée.
b. Calculer les
masses d'acide éthanoïque A ( MA =60 g/mol) et d'éthanoate
de sodium B ( MB = 82 g/mol) à dissoudre dans l'eau
pour obtenir le tampon désiré, sachant que la somme
des concentrations de A et B vaut 0,05 mol/L.
pKa(CH3COOH / CH3COO-) =
4,75.
pH = pKa + log([CH3COO-
] /[CH3COOH]) ; log([CH3COO-
] /[CH3COOH]) =4,9-4,75 =
0,15.
[CH3COO- ] /[CH3COOH]=1,413 ; [CH3COO-
] =1,413 [CH3COOH].
Or [CH3COO- ] +[CH3COOH]=0,05 ; [CH3COOH]=0,05 /2,413
= 0,0207 mol/L
CH3COOH : 0,0207*0,5 = 0,01036
mol dans 0,5 L soit 0,01036*60 ~0,62 g.
CH3COO- :
0,0293*0,5 =0,01465 mol dans 0,5 L soit 0,01465*82 ~1,2 g.
|
|
|
c. Dans la solution précédente, on
ajoute 80 mg de soude solide. Calculer la variation de pH résultant.
Quelle aurait été la variation de pH de 500 mL d'eau ultra pure, à
l'abri de l'air, après un ajout identique ?
n( NaOH) = 0,080 / 40 = 0,002 mol.
Il se forme 0,002 mol d'ion éthanoate et 0,002 mol d'acide éthanoïque
disparaît.
n(CH3COO-)
= 0,01465 +0,002 = 0,01665 mol dans 0,5 L.
n(CH3COOH)=0,01036-0,002 =0,00835 mol
dans 0,5 L.
pH
= 4,75 +log ( 0,01665
/
0,00835)
=5,05. Variation de pH : + 0,15.
Dans le cas de l'eau ultra-pur de pH initiale 7 :
pH final = 14+log (0,002 / 0,5)=11,6.
Variation de pH : + 4,16.
Exercice
4.
Des effluents industriels contiennent une suspension de sulfate de
plomb dans l'eau.
a. Donner la solubilité du sulfate
de plomb en g/L.
Ks(PbSO4) = 2 10-8 = [Pb2+aq][SO42-aq]
= s2 ; s =1,41 10-4 mol/L.
M(PbSO4) =302 g/mol ; 1,41 10-4 *302
=4,27 10-2 ~4,3 10-2
g/L.
b. Calculer la masse de sulfate de sodium à ajouter par litre
d'effluent pour que, dans un premier traitement, on puisse faire
précipiter 98 % du sulfate de plomb dissout.
[SO42-aq]
= s + [Na2SO4]= s + c ; [Pb2+aq] = 0,02 s.
2 10-8 =0,02 s(s+c) ; c = 10-6 / s -s = 10-6
/ (1,41 10-4) -1,41 10-4=6,93 10-3
mol/L.
M(Na2SO4) =142 g/mol ; 6,93 10-3 *142
=4,27 10-2 ~0,98 g/L.
|
|
|
|
Exercice
5.
Dosage par étalonnage des ions SCN- de la salive.
Les ions thiocyanate forme un complexe coloré avec les ions ferriques :
le complexe Fe(SCN)2+.
a. Donner le nom du complexe.
Ion thiocyanato fer(III).
b. Donner le schéma de Lewis de l'ion SCN-, les atomes
sont liés dans cet ordre. Si plusieurs formules mésomères
sont possibles, on les indiquera.
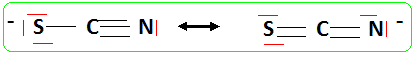
c. Déterminer la
concentration en complexe Fe(SCN)2+ obtenue lorsqu'on
réalise une solution de nitrate ferrique Fe(NO3)3
à 2,0 10-4 mol/L et de thioscyanate de potassium à la même
concentration.
On donne pour l'ion Fe(SCN)2+ pKd = 2,2 où Kd
est la constante de dissociation.
Fe3+ + SCN- = Fe(SCN)2+ K = 1/KD
=102,2 = 158,5 = [ Fe(SCN)2+] / ([ SCN-][Fe3+])
|
avancement (mol/L)
|
Fe3+
|
+ SCN-
|
= Fe(SCN)2+
|
|
initial
|
0
|
2,0 10-4
|
2,0 10-4
|
0
|
|
final ( équilibre)
|
x
|
2,0 10-4 -x
|
2,0 10-4 -x
|
x
|
158,5 = x / (2,0 10-4 -x)2 ; x/ 158,5 = (2,0 10-4
-x)2 = x2 -4 10-4 x + 4 10-8
;
x2-6,71 10-3x + 4 10-8 =0 ; x = 5,9 10-6 mol/L.
On prépare la gamme d'étalonage suivante en introduisant
dans les tubes numérotés 0 à 5 du nitrate ferrique en excès et du
thiocyanate de potassium dans de l'acide nitrique dilué.
Pour simplifier on donne directement la concentration c en complexe
Fe(SCN)2+ présent dans chaque tube.
Le tube 0 ne contient que du nitrate ferrique et de l'acide nitrique,
dans des concentrations identiques à celles des tubes 1 à 5
|
tube n°
|
0
|
1
|
2
|
3
|
4
|
5
|
|
c (mol/L)
|
0
|
4,0 10-5
|
8,0 10-5
|
1,2 10-4
|
1,6 10-4
|
2,0 10-4
|
Après réalisation du blanc, le spectre du tube n°5 est tracé et
représenté ci-dessous.
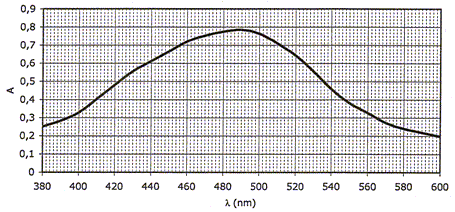
d. Que contient la solution placée
dans la cuve pour réaliser le blanc ? Que est l'intérêt de la
réalisation du blanc ?
Faire le blanc, c'est faire une mesure d'absorbance, à la longueur
d'onde choisie, en mettant dans la cuve uniquement le solvant ( eau et
acide nitrique). Le spectrophotomètre le considèrera comme ligne de
base (le zéro) pour les prochaines mesures.
L'absorbance mesurée en suite sera uniquement due à l'epèce étudiée
Fe(SCN)2+
Donner en
justifiant la couleur de l'ion Fe(SCN)2+. A quelle longueur
d'onde doit-on se placer pour réaliser les mesures d'absorbance par la
suite ? Justifier.
L'absorbance est maximum dans l'intervalle 440- 520 nm. La solution
absorbe la partie bleu vert de la lumière blanche : elle diffuse la
couleur complémentaire, le rouge. On choisit la longueur d'onde
correspondant au maximum d'absorption l =
490 nm.
A cette longueur
d'onde les résultats des mesures d'absorbance ( notée A) des différents
échantillons sont récapitulés dans le tableau suivant :
|
tube n°
|
0
|
1
|
2
|
3
|
4
|
5
|
|
c (mol/L)
|
0
|
4,0 10-5
|
8,0 10-5
|
1,2 10-4
|
1,6 10-4
|
2,0 10-4
|
|
A
|
0
|
0,128
|
0,291
|
0,462
|
0,634
|
0,785
|
e. Tracer la droite d'étalonnage A=
f(c) . Quelle loi vérifie t-on ?
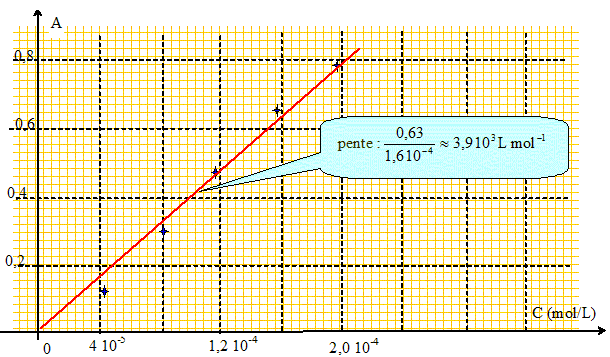
Le graphe A = f(C) est une droite : la loi de Beer
Lambert est vérifiée.
Un prélevement de salive est collecté et centrifugé.
Aprés centrifugation, on introduit 250 µL de la solution limpide
surnageante dans 10,0 mL de la solution de nitrate ferrique. Dans ces
conditions tous les ions thiocyanate de la salive sont complexés.
L'absorbance, mesurée dans les mêmes conditions que précédemment est de
0,654.
f. En déduire la concentration en
complexe Fe(SCN)2+ dans la cuve, puis en ion thiocyanate
dans la salive.
A = 3,9 103 c ; c = 0,654 / 3,9 103 =1,7 10-4
mol/L dans la cuve.
Facteur de dilution : 10 / 0,25 = 40.
Concentration en ion Fe(SCN)2+ dans la salive : 1,7 10-4*40
=6,7 10-3 mol/L.
Dans ces conditions tous les ions thiocyanate de la salive sont
complexés.
[SCN-] = 6,7 10-3 mol/L = 6,7 mmol/L.
|
|
|
|