Synthèse de
l'acébutolol.
Bts chimiste 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Partie I. Synthèse de l'épichlorhydrine.
La synthèse industrielle de l’épichlorhydrine est décrite ci-dessous :
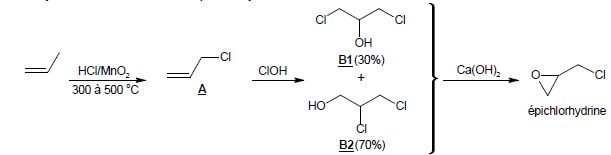
Remarque : les réactifs HCl et MnO2
permettent de former du dichlore in situ lors de la première étape. Le
dichlore réagit ensuite avec le propène pour conduire au produit A.
1.1. Donner le nom des espèces B1 et B2 en nomenclature systématique.
B1 : 1,3-dichloropropan-2-ol ; B2 : 2,3-dichloropropan-1-ol.
1.2. Préciser le nombre de stéréo-isomères que possède l’épichlorhydrine. Justifier la réponse.
Il existe un atome de carbone asymétrique, donc deux énantiomères.
1.3. Représenter
chaque stéréo-isomère de l’épichlorhydrine en utilisant la
représentation de Cram. Indiquer le (ou les) descripteur(s) R ou S
associé(s).
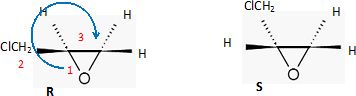
1.4. Écrire l’équation de la réaction de formation de A à partir de dichlore et de propène.
CH2=CH--CH3 + Cl2 ---> CH2=CH---CH2Cl + HCl.
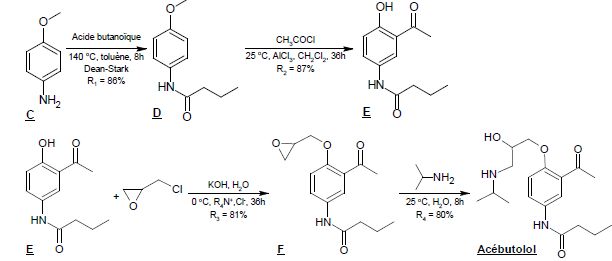
Partie II : première voie de synthèse de l’acébutolol à partir de la 4-méthoxyaniline.
|
|
|
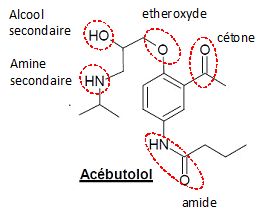
2.1. Recopier la
formule topologique de l’acébutolol ; repérer précisément sur cette
formule tous les groupes caractéristiques et nommer les différentes
familles (fonctions) organiques correspondantes.
2.2. Proposer une suite réactionnelle permettant d’obtenir C à partir du 4-aminophénol.
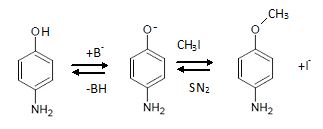
Formation d'un éther méthylique avec CH3I, protection du phénol.
2.3. Justifier la nécessité de protéger un groupe caractéristique du 4-aminophénol en
formant
C au début de cette synthèse. Écrire l’équation de la réaction «
parasite » susceptible de se produire en l’absence de protection.
Sans protection, le phénol est estérifié par l'acide butanoïque.
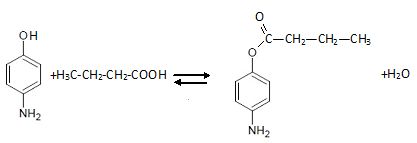
2.4. Justifier l’utilisation du Dean-Stark lors de l’étape C → D.
Elimination de l'eau. L'équilibre est déplacé dans le sens direct.
2.5. Lors de l’étape D → E, le catalyseur AlCl3 est introduit en large excès (2,6 équivalents de AlCl3 pour 1 équivalent de D) ; expliquer.
Il y a simultanément acylation du noyau benzénique et « déprotection » du groupe caractéristique du phénol.
Un équivalent de AlCl3 est utilisé pour l'acylation du noyau aromatique.
2.6. La vitesse de
l’étape de formation de l’Acébutolol à partir du composé F a un ordre
global égal à deux. En déduire le type de réaction mis en jeu au cours
de cette étape.
Pour une SN2, la vitesse dépend de la concentration en substrat et de la concentration du nucléophile : donc ordre 2.
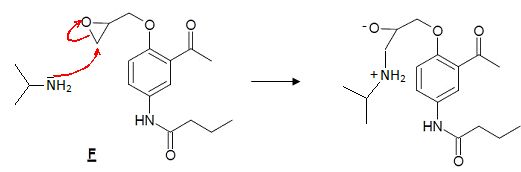
2.7. Détailler le mécanisme de l’étape de formation de l’Acébutolol en partant du
stéréo-isomère S de F. Donner la stéréochimie de l’isomère obtenu et justifier la régiosélectivité de la réaction.
L'amine est encombrée, l'attaque se produit à l'endroit où la gène stérique est la plus faible.
Le carbone asymétrique n'est pas affecté et ne change pas de configuration.
2.8. Le stéréo-isomère S de l’acébutolol a un pouvoir rotatoire en solution dans le méthanol égal à : [a] 20D = +2,7°. Indiquer si ce stéréo-isomère est lévogyre ou dextrogyre.
Dextrogyre : pouvoir rotatoire positif.
2.9. Déterminer le rendement global Rs1 de la première voie de synthèse de l’acébutolol.
Rs1 =R1 x R2 x R3 x R4 =0,86 * 0,87 *0,81 *0,80 ~0,48 ( 48 %).
2.10. Les détails du spectre de RMN 1H (400 MHz, CDCl3) de D sont donnés dans le tableau ci-dessous. Attribuer les signaux observés aux protons HA à HF. Compléter le tableau.
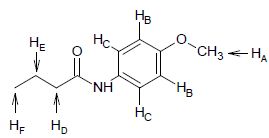
Proton
|
d (ppm)
expérimental
|
d (ppm)
calculé si nécessaire |
Multiplicité
|
Intégration
|
HA
|
3,79
|
|
s
|
3H
|
| HB |
6,86
|
7,28 -0,47-0,30 =6,51
|
d
|
2H
|
| HC |
7,42
|
7,28+0,40-0,44 =7,24
|
d
|
2H
|
| HD |
2,33
|
0,23+1,47+0,68=2,38
|
t
|
2H
|
| HE |
1,77
|
|
m
|
2H
|
| HF |
1,02
|
|
t
|
3H
|
NH
|
7,05
|
|
s
|
1 H
|
.
|
|
|
|
Partie III : deuxième voie de synthèse de l’acébutolol® à partir du phénol
La deuxième voie de synthèse est décrite ci-dessous :
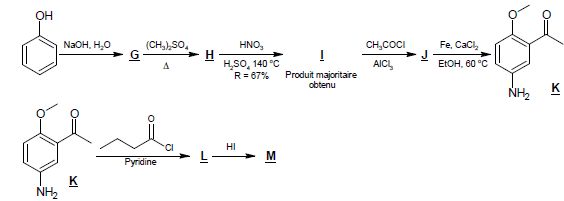
3.1. Déterminer les formules topologiques des espèces G, H, I, J, L et M.
Le sulfate de diméthyle (CH3)2SO4 est un agent méthylant analogue à un halogénure de méthyle comme CH3I.
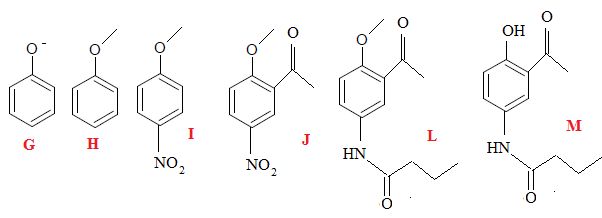
3.2. Donner la
formule de l’électrophile intervenant dans la nitration de H. Écrire
l’équation de la réaction conduisant à sa formation.
HNO3 +H2SO4 = NO2+ +HSO4- +H2O.
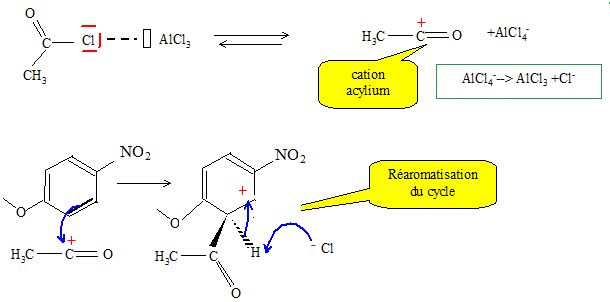
3.3. Détailler le mécanisme de la réaction : I → J. Donner le type et le nom de cette réaction. Justifier l’orientation observée.
Le groupe NO2 désactive les positions ortho. L'acylation du noyau benzénique s'effectue en méta du groupe NO2.
3.4. Indiquer le type de réaction correspond à chacune des étapes : phénol → G et J → K.
phénol --> G : réaction acide base.
J--> K : réduction de NO2 en NH2.
3.5. Calculer le rendement maximal Rs2 que peut atteindre cette deuxième voie de synthèse de l’acébutolol
Le rendement de formation de H est de 72-75% en partant du phénol ;
- M est obtenu à partir de I de façon pratiquement quantitative.
Les deux dernières étapes de cette voie se déroulent dans des conditions identiques à la voie 1 décrite précédemment.
Rs2 = 0,75 *0,67 *0,81*0,80 = 0,325 ( ~33 %).
4. Rédiger un court argumentaire proposant la voie de synthèse de l’acébutolol.
Le rendement de la voie 1 est supérieur à celui de la voie 2.
Le nombre d'étapes de la voie 1 est inférieur à celui de la voie 2. Donc voie 1.
Mais il faut tenir compte du coût des réactifs, des catalyseurs ainsi que du recyclage des sous produits.
|
|