Utilisations du
plomb. Bts chimiste 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. Les canalisations en plomb.
Le
plomb sous forme de métal a été employé depuis l'antiquité en raison de
sa grande malléabilité et ductilité ainsi que d'une relative résistance
à la corrosion, en milieu non acide dans l'air et le sol, notamment
pour la réalisation de conduites d'eau potable, de plaques de toiture
et de gouttières.
Cependant, l’eau en contact avec le plomb peut contenir des ions Pb2+ dont la toxicité est reconnue. Or, les ions Pb2+ issus de la corrosion d'une paroi de canalisation en plomb peuvent réagir avec les anions carbonate CO32- et former du carbonate de plomb solide. La solubilité du carbonate de plomb PbCO3 formé dépend du pH de l'eau qui circule dans la canalisation.
On se propose de prévoir le caractère potable ou non d’une eau en contact avec une canalisation en plomb.
1.1. Donner le diagramme de prédominance, en fonction du pH, des différentes espèces acido-basiques dérivées du dioxyde de carbone.
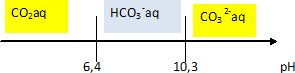 1.2. Écrire l’équation de la réaction prépondérante de dissolution du carbonate de plomb dans une eau de pH constant et égal à 7,5.
1.2. Écrire l’équation de la réaction prépondérante de dissolution du carbonate de plomb dans une eau de pH constant et égal à 7,5.
PbCO3(s) + H2O(l) = Pb2+aq + HCO3-aq+ HO-aq.
1.3. Exprimer la constante d'équilibre de cette réaction prépondérante KRP en fonction du produit de solubilité Ks du carbonate de plomb et du (ou des) constante(s) d’acidité.
Calculer sa valeur numérique.
KRP =[HO-aq][HCO3-aq][Pb2+aq].(1)
Ks = [CO32-aq][Pb2+aq].
Ka2 = [CO32-aq][H3O+aq] /][HCO3-aq].
Ks / Ka2 = [Pb2+aq] [HCO3-aq] /[H3O+aq].
Repport dans (1) : KRP =[HO-aq][H3O+aq] Ks / Ka2 =Ke Ks / Ka2.
KRP =1,0 10-14 *8 10-15 / (5 10-11) =1,6 10-18.
1.4. En déduire la valeur de la solubilité s du carbonate de plomb à ce pH.
[HO-aq]=10-6,5 = 3,16 10-7 mol/L.
s = [HCO3-aq] =[Pb2+aq] = { KRP / [HO-aq] }½ =[1,6 10-18 / (3,16 10-7)]½ =2,2 10-6 mol/L.
1.5. Calculer la teneur en plomb TPb (en μg.L-1) et conclure sur la problématique étudiée, en se référant aux normes relatives à l’eau potable.
TPb = s M(Pb) =2,2 10-6 *207,2 ~4,7 10-4 g/L =4,7 102 µg /L.
Cette valeur étant supérieure à 10 µg/L, cette eau ne peut pas être utilisée pour la consommation humaine.
2. L’accumulateur au plomb.
L'accumulateur au plomb a été inventé en 1859 par le français Gaston
Planté. Il a été en effet le premier à avoir mis au point une batterie
rechargeable. À l'origine, les accumulateurs étaient situés dans des
cuves en verre. Par la suite, on a systématisé l'emploi des cuves en
plastique, qui résistent mieux aux chocs. Les batteries constituent
aujourd'hui la principale utilisation du plomb (72 % de la consommation
mondiale de plomb). Cette technique, simple et robuste, est également
très
compétitive et reste à ce jour la principale technique pour les batteries de démarrage des véhicules.
|
|
|
2.1. Principe de fonctionnement d’un accumulateur au plomb
L'accumulateur au plomb est assimilé à un ensemble de piles
électrochimiques « réversibles » délivrant au total une tension de 12 V.
Chaque pile comporte :
· une électrode constituée d’une lame de plomb ;
· une électrode constituée d’une couche de dioxyde de plomb PbO2(s) déposée sur un support inerte ;
· un électrolyte constitué d’une solution d’acide sulfurique concentré.
Chaque pile peut être modélisée par la chaîne électrochimique suivante :
Pb(s) / Pb2+(aq) / solution d’acide sulfurique concentré / Pb2+(aq) / PbO2(s).
2.1.1. Exprimer les
potentiels des deux électrodes, puis la tension à vide aux bornes de la
pile ainsi constituée. Si dans la solution, la concentration en ion
plomb (II) est [Pb2+] = 1,0 x10-6 mol.L-1 et si la valeur du pH est pH = 0, vérifier que la valeur de cette tension à vide est de l’ordre de 2 volts.
2.1.2.
Associer à chaque électrode sa polarité, son nom et la réaction
électrochimique qui s’y déroule lors du fonctionnement de la pile en
générateur (décharge).
Oxydation du plomb à l'anode négative : Pb(s) = Pb2+aq + 2e-.
E1 = E°(Pb2+aq / Pb(s)) +0,03 log [Pb2+aq].
Réduction de PbO2(s) à la cathode positive : PbO2(s) +4H+aq +2e- = Pb2+aq + 2H2O.
E2 = E°(PbO2(s) / Pb2+aq) +0,03 log ([H+aq]4 / [Pb2+aq]).
E =E2 - E1 =E°(PbO2(s) / Pb2+aq) -E°(Pb2+aq / Pb(s)) + 0,03 log ([H+aq]4 / [Pb2+aq]2 ).
E = 1,45 -(-0,15) +0,03 log(1/ (1,0 10-12))=1,60 +0,36 = 1,96 ~2,0 V.
2.1.3. Écrire l’équation de la réaction (D) modélisant la décharge de la pile.
Pb(s) + PbO2(s) +4H+aq = 2 Pb2+aq + 2H2O.
2.1.4. Justifier l’emploi d’un électrolyte constitué d’une solution acide.
L'ion H+aq est l'un des réactifs.
2.1.5. Expliquer comment faire en pratique pour que l’accumulateur au plomb délivre une tension de l’ordre de 12 volts.
Associer 6 éléments en série.
|
|
|
|
2.2. Dosage du plomb dans l'air d’une entreprise de recyclage de batterie au plomb
Dans les usines recyclant les accumulateurs au plomb, les opérateurs
sont au contact de poussières de plomb. On prélève régulièrement des
échantillons d'atmosphère, afin de vérifier que la VLEP (Valeur Limite
d'Exposition Professionnelle) n'est pas atteinte.
La technique la plus utilisée pour doser le plomb dans l’atmosphère est
la spectrophotométrie d’absorption atomique de flamme : (SAA flamme).
Cette technique est précise à 5 % près.
Afin d'effectuer la gamme d'étalonnage en six points, on dispose :
- d’une solution étalon de concentration massique 100 mg/L en plomb ;
- d’une pipette automatique à volume variable de : 200 μL - 1000 μL.
Pour réaliser cette gamme, les volumes prélevés vont de 0 à 1000 μL comme indiqué dans le tableau suivant :
N° fiole
|
1
|
2
|
3
|
4
|
5
|
6
|
Volume solution étalon ( µL)
|
0
|
200
|
400
|
600
|
800
|
1000
|
Concentration des solution ( mg/L)
|
0
|
0,200
|
0,400
|
0,600
|
0,800
|
1,00
|
Volume
|
qsp acide nitrique 5 % 100 mL
|
2.2.1.
Déterminer la valeur de la concentration en plomb de chaque solution de
la gamme d’étalonnage. Expliciter au moins un calcul et compléter le
tableau.
Fiole n°2 : facteur de dilution = 100 / 0,200 = 500 ; concentration : 100 /500 = 0,200 mg/L.
2.2.2. Indiquer les précautions à prendre, du point de vue de la sécurité, pour préparer cette gamme d’étalonnage.
Port de blouse, gant et lunette de protection, l'acide nitrique est corrosif.
Ne pas jeter à l'évier la solution étalon, elle contient des métaux lourds.
Deux échantillons d’air sont prélevés à l'aide d'une pompe étalonnée et
équipée d'un portefiltre et d'un filtre, à poste fixe dans une
entreprise de recyclage des batteries au plomb. Le premier échantillon
est prélevé sur le poste de fours de réduction, le second sur le poste
de broyage.
Conditions opératoires des deux prélèvements et absorbances mesurées en spectroscopie d’absorption atomique de flamme :
Echantillon
|
1
|
2
|
Durée du prélevement ( min)
|
240
|
240
|
Débit de la pompe ( L /min)
|
2
|
2
|
Volume prélevé ( m3)
|
2*0,24 = 0,48 m3
|
2*0,24 = 0,48 m3 |
Mise en solution
|
Acide nitrique 5 %
|
Acide nitrique 5 % |
Volume des fioles jaugées
|
100 mL
|
Absorbance
|
0,170
|
0,210
|
Concentration des solutions d'échantillon ( mg/L)
|
0,49
|
0,62
|
Masse de plomb dans l'échantillon ( mg)
|
0,49*0,100=0,049
|
0,62*0,100=0,062
|
Concentration dans l'atmosphère ( mg m-3)
|
0,049 /0,48 =0,102 ~0,10
|
0,062 /0,480 =0,13
|
2.2.3. Déterminer la valeur de la concentration en plomb (en mg.m-3) de chacun des deux échantillons prélevés et compléter le tableau ci-dessus.
2.2.4. Conclure sur le respect de la législation de ces deux postes de travail.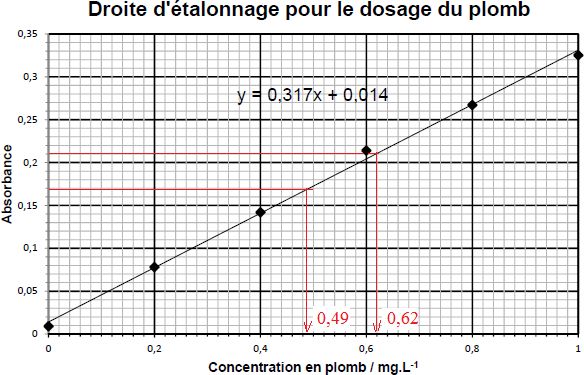
VLEP = 0,10 mg m-3. L'un des postes ne respecte pas la législation.
|
|