Elaboration
industrielle du plomb. Bts chimiste 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. L'élément plomb.
Donner la structure électronique de l'ion Pb2+( Z = 82). Indiquer quel autre degré d'oxydation du plomb est envisageable.
Structure électronique du plomb : [Xe] 4f14 5 d10 6s2 6 p2.
Structure électronique de l'ion Pb2+ : [Xe] 4f14 5 d10 6s2.
Autre degré d'oxydation envisageable :+ IV. [Xe] 4f14 5 d10.
2. Le minerai – Étude cristallographique de la galène.
Le procédé d’élaboration du plomb par voie sèche repose sur
l’extraction et l’exploitation d’un minerai, le sulfure de plomb PbS,
ou galène. Ce dernier possède une structure du type NaCl (les ions
sulfure S2- constituent un réseau cubique faces centrées et les ions Pb2+ en occupent
tous les sites octaédriques).
2.1. Représenter la maille élémentaire du réseau cristallin de la galène.
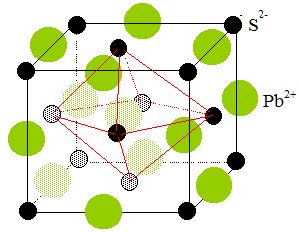
2.2. Déterminer le nombre d'unité(s) PbS dans cette maille.
Chaque ion
situé au sommet du cube est commun à huit mailles, il compte pour
1/8.
Les ions situés sur les huit sommets comptent pour 1/8 *8 = 1.
Chaque ion situé au centre d'une face est commun à 2 mailles : il
compte pour 1/2.
Les 6 ions situés aux centres des 6 faces comptent pour 1/2*6 = 3.
Les ions situés au milieu d'une arète appartiennent à 4 mailles et comptent pour 1/4.
Les 12 ions situés aux milieux des arètes comptent pour 12 / 4 = 3.
L'ion central compte pour un.
Il y a donc 4 ions sulfure et 4 ions Pb2+ par maille, soit 4 unité PbS par maille.
2.3. Donner la
valeur du paramètre a de la maille en utilisant les valeurs des rayons
ioniques et en supposant ce cristal ionique parfait.
a = 2r+ +2r- =2(120 +180) = 600 pm.
2.4. En déduire la valeur de la masse volumique théorique du sulfure de plomb. Commenter.
La maille compte en propre 4 motifs PbS.
Masse de la maille : 4 * masse molaire PbS (kg/mol)
/ nombre d'Avogadro ; m = 4 MPbS / NA.
Volume de la maille V =a3. (en m3)
Masse volumique (kg/m3 ) : r = m /V=4 MPbS / (a3NA)
r =4*239,3 10-3
/ ((600 10-12)3 * 6,023 1023) =7,36 103
kg/m3.
Cette valeur diffère de la valeur réelle ( 7,6 103 kg m-3) d'environ 3 %. Le cristal ionique n'est pas parfait.
|
|
|
3. Oxydation de la galène – Obtention du plomb.
La première étape du procédé industriel d’élaboration du plomb consiste
en une étape de grillage de la galène, effectuée à 700 °C, selon la
réaction d’équation :
2 PbS(s) + 3 O2(g) = 2 PbO(s) + 2 SO2(g)
L’oxyde de plomb PbO est ensuite réduit en plomb dans un haut-fourneau
en présence de coke (carbone) à 1000 K, suivant la réaction (1)
d’équation :
2 PbO(s) + C(graphite) = 2 Pb(l) + CO2(g) (1)
|
|
|
|
3.1. Déterminer, à 298 K, l’enthalpie standard DrH° et l’entropie standard DrS° de la réaction (1).
DrH° =2 DfH°( Pb(s)) + DfH°( CO2(g))-2 DfH°( PbO(s)) - DfH°( C(s)).
DrH° =2*5,10+(-394) -2(-220)-0 = 56,2 kJ / mol.
DrS° =2 S°( Pb(s)) + S°( CO2(g))-2 S°( PbO(s)) - S°( C(s)).
DrS° =2*81,9+214 -2*66,5-5,70 = 239,1J mol-1 K-1.
3.2. L’enthalpie libre standard DrG° de la réaction (1), en fonction de la température, peut s’exprimer sous la forme :
DrG° = 56,2 – 0,239 T, en kJ.mol-1. Justifier cette expression et préciser l’approximation faite.
DrG° =DrH° -TDrS° = 56,2 -0,239 T en supposant DrH° et DrS° indépendant de la température dans l'intervalle d'étude, en dehors des changements d'état.
3.3.
Comparer les valeurs des constantes d'équilibre K° de la réaction (1) à
298 K et à 1000 K. Ce résultat était-il prévisible ? Donner deux
arguments justifiant la température choisie dans le procédé industriel.
DrG°298 =56,2 -0,239 *298 ~-15,0 kJ /mol.
ln K298 = -DrG°298 / (RT )= 15,0 103/(8,314*298) =6,06 ; K298 = 4,3 102.
DrG°1000 =56,2 -0,239 *1000 ~-183 kJ /mol.
ln K1000 = -DrG°1000 / (RT )= 183 103 /(8,314*1000) =22,01 ; K1000 = 3,6 109.
K1000 >>K298 : une réaction endothermique (DrH° >0) est favorisée par une élévation de température.
A 1000 K, PbO est encore solide ( Tfusion = 1100 K) alors que le plomb est liquide ( Tfusion ~ 600 K), donc plus facile à récupérer par coulée.
En dessous de 1000 K CO est négligeable devant CO2.
3.4. Pour optimiser l’obtention du plomb liquide, faut-il opérer à basse ou haute pression ? Justifier.
A température constante, une hausse de la pression déplace l'équilibre dans le sens indirect, diminution des molécules gazeuses.
Il faut donc opérer à basse pression.
|
|
