Réparation des
bétons armés carbonatés. Bac S
Inde 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Le
but de cet exercice est d'estimer la durée nécessaire au traitement par
réalcalinisation pour réparer les bétons carbonatés des façades de la
Cité Radieuse de Marseille.
Questions préalables :
1. Expliquer comment savoir si un morceau de béton est carbonaté.
On réalise un diagnostic de l'état de carbonatation du béton en
prélevant un échantillon de béton sur lequel un indicateur
colorimétrique de pH (phénolphtaléine) est pulvérisé.
A pH supérieur à 8, la phénolphtaléine est rose.

Tous les bétons sont concernés : le dioxyde de carbone (CO2)
présent dans l'atmosphère diffuse sous forme gazeuse dans le béton du
fait de sa porosité et s’y dissout. Cela entraîne une baisse de la
concentration en ions hydroxyde de formule HO–. Le pH se
stabilise alors autour de 8, ce qui conduit à la dissolution des
hydrates du ciment, principalement l'hydroxyde de calcium Ca(OH)2.
Les ions calcium ainsi libérés précipitent avec le dioxyde de carbone
pour donner du carbonate de calcium. Lorsque l'hydroxyde de calcium a
été entièrement consommé le milieu s'acidifie et la phénolphtaleine
reste incolore.
2. Montrer que la réfection de 1 m2 de façade de la Cité Radieuse consiste à réalcaliniser environ 2,5×10-2 m3 de béton.
Le béton ci-dessus est carbonaté sur une profondeur d'environ 2,5 cm soit 2,5 10-2 m.
Il faut donc réalcaliniser : 2,5 10-2 m3 de béton par m2 de surface de façade.
|
|
|
Problème :
Évaluer la durée nécessaire au traitement par réalcalinisation
permettant la régénération de tous les ions hydroxyde perdus lors de la
carbonatation d'un parement de béton d'une surface de 1 m2 de la Cité Radieuse de Marseille. Commenter le résultat obtenu.
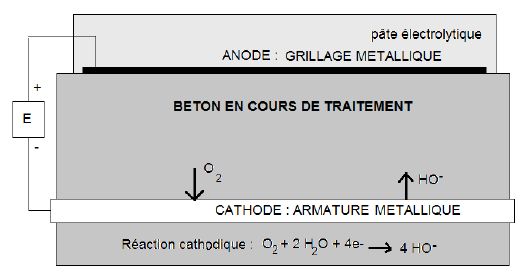
Traitement du béton par réalcalinisation à courant imposé.
Il s'agit d'une méthode électrochimique qui consiste à :
- se connecter sur les armatures du béton et à les utiliser comme cathode ;
- poser temporairement, à la surface du béton, un grillage métallique servant d'anode, noyé dans une pâte électrolytique ;
- faire passer un courant entre anode et cathode, en les reliant à un générateur de courant.
|
|
|
|
Le
traitement est une électrolyse au cours de laquelle le dioxygène
produit à l’anode est réduit à la cathode. Il y a alors formation
d’ions hydroxyde à la cathode. Cela conduit à l'augmentation du pH du
béton corrigeant ainsi la diminution de pH consécutive à sa
carbonatation.
Le traitement est réalisé avec une densité de courant imposé de valeur comprise entre 0,5 et 1 A.m–2 et sa durée est de une à deux semaines.
Dans les monuments historiques, les façades apparentes ne doivent pas
changer d’aspect. La réalcalinisation est alors un traitement adapté, à
condition que le front de carbonatation n’ait pas encore atteint
l’armature.
D'après Bulletin du ciment, numéro 21, septembre 1993.
et Construction Moderne - Ouvrage d'Art - Annuel 2011.
Données :
Charge électrique transportée par une mole d'électrons : 96500 C
Charge électrique élémentaire : e = 1,60 x10-19 C
Constante d’Avogadro : NA = 6,02 x 1023 mol-1
I = Q / Dt avec :
I : intensité du courant en A
Q : charge électrique transportée par le courant en C
Dt : durée du transfert des charges en s
Masse molaire de l'hydroxyde de calcium : M(Ca(OH)2) = 74 g.mol-1.
Il faut donc réalcaliniser : 2,5 10-2 m3 de béton par m2 de surface de façade.
Dissolution des hydrates : Ca(OH)2(s) = Ca2+aq + 2 HO-(aq).
Les ions calcium précipitent : Ca2+aq + 2 HO-(aq) + CO2 (aq) = CaCO3(s) + H2O.
Le béton est obtenu en incorporant du ciment à un mélange de sable et graviers (granulats), le tout additionné d'eau.
Après hydratation du ciment, 1 m3 de béton contient 30 kg d'hydroxyde de calcium Ca(OH)2.
2,5 10-2 m3 de béton contient 30*2,5 10-2 = 0,75 kg d'hydroxyde de calcium Ca(OH)2.
Quantité de matière d'hydroxyde de calcium ayant disparu dans un béton à réalcaliniser :
n = 0,75 *1000 / 74 = 10,135 ~10 moles.
Quantité de matière correspondante d'ion hydroxyde : 2n = 20,27 ~20 moles.
D'après la réaction cathodique, la quantité de matière d'électron est
égale à la quantité de matière d'ion hydroxyde formé soit n(e-) ~20 moles.
Quantité d'électricité correspondante Q = 20,27 *96500 = 1,956 106 C.
Si I = 0,5 A m-2 : Dt = 1,956 106 / 0,5 ~3,9 106 s soit environ 45 jours.
Si I = 1 A m-2 : Dt ~22 jours.
Ces valeurs sont trois fois supérieures à celles proposées dans le
texte. Ce béton très ancien ( 1950) est carbonaté en plus grande
profondeur que des bétons plus récents.
|
|