Adaptation du pH
de l'eau d'un aquarium. Bac S
Inde 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Un
aquarium et tout ce qu’il contient forment un système complexe à
l’équilibre fragile. De nombreux facteurs peuvent provoquer un
déséquilibre dangereux pour la vie et la santé des poissons. En
particulier, le pH de l’eau est une grandeur à mesurer régulièrement et
à réguler si nécessaire. Il ne doit pas varier de plus de 0,5 unité de
pH.
Un aquariophile débutant n’arrive pas à réguler le pH de son aquarium
qui contient des plantes et des poissons (scalaires, néons cardinal et
guppys). Le matin, le pH de l’eau est d’environ 6,7 et le soir de 7,5.
Cet exercice a pour but d’aider l’aquariophile à réguler le
fonctionnement de son aquarium.
Sur les forums d’aquariophilie on peut trouver quatre techniques
d’ajustement du pH :
Technique
n°1. Ajouter un peu d’acide sulfurique, commercialisé, par
exemple, sous la dénomination « pH minus ». Il s’agit d’un acide fort,
la variation du pH sera rapide et peut-être plus importante que
souhaitée.
Technique
n°2. Injecter du dioxyde de carbone dans l’eau.
Pour injecter du dioxyde de carbone dans un aquarium, le plus simple
est d’utiliser un kit comprenant un bulleur, un détendeur et une
bouteille pressurisée.
Ce système peut être couplé à une électrovanne programmable permettant
de choisir les horaires des périodes d’injection du dioxyde de carbone.
Le système peut encore être optimisé en combinant un pH-mètre à
l’installation, permettant une gestion automatisée de la régulation du
pH.
D’après : http://www.aqua-planete.com/CO2.php
Technique
n°3. Ajouter une solution contenant des ions hydroxyde de
formule HO–. L’ajout doit être modéré car si l’eau devient
trop basique, les ions ammonium présents dans l’eau pourraient se
transformer en ammoniac, un gaz dissous particulièrement toxique pour
les poissons.
Technique
n°4. Ajouter de la craie dans l’eau de l’aquarium.
Données :
- Les craies traditionnelles sont composées presque exclusivement de
carbonate de calcium, un solide ionique constitué d’ions calcium Ca2+
et carbonate CO32- .
- Masse molaire du carbonate de calcium : M(CaCO3) = 100
g.mol-1.
- Masse d’un bâton de craie : environ 10 g.
H2CO3/HCO3– pKa1
=6,3
HCO3–/CO32- pKa1 =10,3
Consommation et production de
dioxyde de carbone et de dioxygène par les plantes aquatiques et les
poissons :
De jour comme de nuit, les poissons respirent ; ils absorbent donc du
dioxygène et rejettent du dioxyde de carbone.
En ce qui concerne les plantes, deux phénomènes sont à prendre en
compte :
- De jour comme de nuit, elles respirent.
- De jour, lorsqu’elles reçoivent de la lumière, les plantes réalisent
la photosynthèse : elles captent du dioxyde de carbone et produisent du
glucose. La photosynthèse est modélisée par la réaction d’équation
suivante :
6CO2+6H2O -->C6H12O6+6O2.
Globalement, lorsqu’elle reçoit suffisamment de lumière, une plante
absorbe plus de dioxyde de carbone par la photosynthèse qu’elle n’en
rejette par la respiration.
|
|
|
1. Une solution « pH minus » vendue pour
faire baisser le pH dans un aquarium contient des ions H3O+
à la concentration de 3,0 mol.L-1. Pour mettre en oeuvre une
des techniques, un aquariophile conseille sur un forum de prélever de
l’eau de l’aquarium dans un récipient propre afin de diluer 50 fois la
solution de pH « minus » avant de l’introduire dans l’aquarium.
Déterminer la valeur du pH de la solution versée dans l’aquarium.
En diluant 50 fois la solution "pH minus", la concentration en ion
oxonium est divisée par 50 soit c = 3,0 / 50 = 0,060 mol/L.
pH de la solution versée dans l'aquarium : pH = - log 0,060 =1,2.
2. Une des
techniques propose d’injecter du dioxyde de carbone. Le dioxyde de
carbone se dissout dans l’eau et y forme l’acide carbonique H2CO3
selon la réaction d’équation suivante :
CO2 (aq) + H2O(l) = H2CO3
(aq)
2.1 À l’aide des
couples acide/base mis en jeu, écrire l’équation de la réaction
intervenant entre l’acide carbonique et l’eau.
H2CO3
(aq) + H2O(l) =
HCO3–aq + H3O+aq.
2.2 Quel est l’effet de cette
injection de dioxyde de carbone sur la valeur du pH de l’eau de
l’aquarium ? Cette injection est-elle à conseiller à l’aquariophile
débutant ?
[H3O+aq]
augmente et le pH diminue.
On peut conseiller cette dechnique à un débutant à condition de
le coupler à une électrovanne programmable permettant de choisir les
horaires des périodes d’injection du dioxyde de carbone.
Le système peut encore être optimisé en combinant un pH-mètre à
l’installation, permettant une gestion automatisée de la régulation du
pH.
2.3 Tracer, sur un axe gradué, les
domaines de prédominance des espèces acido-basiques H2CO3
(aq), HCO3–aq et CO32-
. Déterminer l’espèce prédominante le
matin et le soir dans l’eau de l’aquarium étudié.
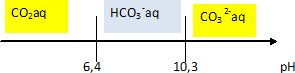
Le
matin, le pH de l’eau est d’environ 6,7 et le soir de 7,5 : HCO3–aq
prédomine.
|
|
|
|
3. On considère un aquarium de
volume 100 L dont l’eau a une valeur de pH égale à 3,0. On se propose
d’étudier l’effet de l’ajout de craie dans l’eau comme proposé dans
l’une des techniques.
3.1 L’ajout d’un
quart de bâton de craie permettra-t-il d’obtenir une solution neutre ?
On modélisera la transformation par la
réaction intervenant entre les ions carbonate CO32–
présents dans la
craie et les ions oxonium H3O+ de l’aquarium
formant de l’acide
carbonique et de l’eau. On considèrera cette réaction comme totale.
CO32-aq
+ 2H3O+ aq
--> H2CO3 aq + H2O(l). ( H2CO3 aq prédomine à pH inférieur à 6,3 )
Quantité
de matière d'ion carbonate ajouté n = 2,5 / M(CaCO3) =
2,5 / 100 = 0,025 mol.
Quantité de matière d'ion oxonium ayant réagi : 2*0,025 =0,050 mol.
Quantité de matière initiale d'ion oxonium : n0 = 100 * 10-pH
= 0,10 mol.
Quantité de matière
d'ion oxonium restante : 0,050 mol.
[H3O+ aq]fin =
0,050 / 100 = 5,0 10-4 mol/L ; pHfin = -log (5,0
10-4) =3,3.
Le pH n'augmente que de 0,3, il ne peut pas atteindre la valeur 7.
3.2 Déterminer
l’espèce prédominante après traitement. La modélisation choisie
est-elle pertinente ?
Après traitement H2CO3 aq prédomine à pH inférieur à 6,3.
La modèlisation n'est pas pertinente, l'ajout de craie doit amener le
pH de l'eau vers 7.
4. Indiquant les
numéros des techniques proposées sur
Internet permettant de faire diminuer ou augmenter le pH.
Les techniques 1 et 2 font diminuer le pH par ajout d'acide.
Les techniques 3 et 4 font croïtre le pH par ajout de base.
5. Synthèse.
En s’appuyant, entre autres, sur les équilibres acides/bases mis en
jeu, rédiger un paragraphe expliquant :
- la variation de pH de 6,7 à 7,5 observée en journée.
- laquelle des quatre techniques convient pour réguler le pH dans
l’aquarium considéré.
Les
poissons respirent ; ils absorbent donc du dioxygène et rejettent du
dioxyde de carbone de jour comme de nuit.
Globalement,
lorsqu'une plante reçoit suffisamment de lumière, elle absorbe plus de
dioxyde de carbone par la photosynthèse qu’elle n’en rejette par la
respiration.
Bilan en dioxyde de carbone durant la journée : décroissance et en
conséquence une augmentation du pH de l'eau.
La technique 1 est trop brutale et ne permet pas d'ajuster correctement
le pH.
La technique 3 est également trop brutale, elle risque de provoquer le
dégagement d'ammoniac nocif.
La technique 2 est la flus fiable.
|
|