Etude d'une lotion
capillaire. Bac S
Liban 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
L’objectif de cet exercice est l’étude de la composition d’une lotion capillaire.
Cette lotion capillaire est un mélange hétérogène de deux phases
liquides non-miscibles contenant des substances actives permettant de
prévenir l’apparition des pellicules et de limiter la chute des cheveux.
La photographie d’un flacon de 300 mL de cette lotion capillaire met en
évidence ces deux phases. Le fabricant indique que la phase huileuse
représente 7 % en volume alors que la phase hydroalcoolique représente
93 % en volume.
Voici un extrait de ce que l’on peut lire sur l’étiquette de ce flacon.
Ingrédients : Eau, pétrole léger désodorisé et coloré par de la
chlorophylle, alcool dénaturé, camphre, huiles essentielles (bergamote,
citron, orange), chlorure de sodium (0,1 % en masse).
Données.
- Miscibilité : l’eau et l’alcool sont totalement miscibles ; l’eau et le pétrole sont non miscibles
- Solubilité de quelques espèces chimiques dans l’eau et le pétrole :
|
Eau
|
Pétrole
|
Chlorophylle
|
Alcool
|
Camphre
|
Huiles essentielles
|
Chlorure de sodium
|
Eau
|
|
Faible
|
Faible
|
Forte
|
Faible
|
Nulle
|
Forte
|
Pétrole
|
|
|
Forte
|
Faible
|
Forte
|
Forte
|
Faible
|
Pourcentage massique : le
pourcentage massique d’une espèce dissoute dans une solution est égal
au rapport de la masse de cette espèce dissoute sur la masse totale de
la solution. Cette grandeur n’a pas d’unité et s’exprime usuellement
sous la forme d’un pourcentage.
1. Les deux phases de la lotion capillaire.
1.1. Sachant que
l’alcool dénaturé est essentiellement constitué d’éthanol, proposer une
interprétation de la grande miscibilité de l’eau et de l’alcool.
L'eau et l'éthanol sont des molécules polaires et le groupe C2H5 de l'éthanol est petit. De nombreuses interactions peuvent s'établir entre les deux molécules.
1.2. Donner la composition chimique de chacune des phases présentes dans la lotion.
Phase aqueuse : eau, alcool, chlorure de sodium.
Phase organique : pétrole, chlorophylle, camphre, huiles essentielles.
1.3. Que peut-on
dire de la densité de la phase hydroalcoolique par rapport à celle de
la phase huileuse ? Donner une réponse argumentée.
La partie supérieure ( 7 % en volume) est la moins dense. Il s'agit de la phase organique.
La phase aqueuse hydroalcoolique ( 93% ), la plus dense, occupe la partie inférieure.
1.4. Proposer une
méthode permettant de séparer les deux phases de la lotion, puis de
vérifier les pourcentages en volume des deux phases indiqués par le
fabricant, en précisant la verrerie utilisée.
Agiter vigoureusement le flacon et prélever rapidement 20 mL de la
solution à l'aide d'une pipette graduée. Placer le prélevement dans une
ampoule à décanter et laisser décanter. Ouvrir le robinet et laisser
s'écouler la phase hydroalcoolique dans une éprouvette graduée de 50
mL. Mesurer le volume obtenu.
|
|
|
2. Vérification de la présence de camphre 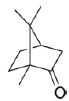 dans la phase huileuse. dans la phase huileuse.
Le camphre, présent dans la phase huileuse de la lotion capillaire, est
un composé oxygéné possédant des propriétés antiseptiques et exerçant
une action stimulante sur le cuir chevelu. Afin de contrôler la
présence de camphre dans la phase huileuse, on réalise une
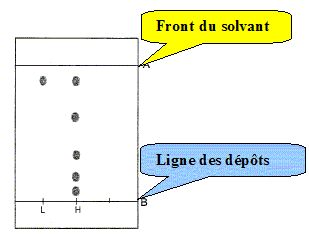
chromatographie sur couche mince. L’éluant utilisé est un mélange de
cyclohexane et d’éthanoate d’éthyle. La révélation du
chromatogramme se fait dans une cuve à diiode.
2.1. À quelle famille de composés organiques appartient le camphre ?
Le camphre appartient à la famille des cétones.
2.2. Rédiger le
protocole de cette chromatographie sur couche mince en listant tout le
matériel et les produits nécessaires à sa réalisation dans les
conditions de sécurité et indiquer le résultat attendu.
Plaque : à gel de silice ;
éluant : mélange cyclohexane/éthanoate d’éthyle (80/20 en volume) ;
dépôts : deux dépôts seront réalisés à l'aide de micropipette après dissolution des produits dans l’éthanol ;
camphre commercial (L étalon) et phase huileuse (H) ;
révélation: c’est une révélation à l’iode. Après élution et séchage à l’air de la plaque,
déposez-la dans la cuve à iode et agiter. Attendre la
révélation des produits puis entourer les tâches observées.
|
|
|
|
3. Titrage des ions chlorure présents dans la phase hydroalcoolique.
On désire maintenant vérifier expérimentalement la valeur du pourcentage massique du chlorure de sodium (Na+(aq) + Cl-(aq))
dissous dans la phase hydroalcoolique de la lotion capillaire pour la
comparer à la valeur indiquée sur son étiquette. Pour cela, on réalise
un titrage des ions chlorure par une solution titrante de nitrate
d'argent de formule chimique (Ag+(aq) + NO3–(aq)) et de concentration molaire C = 2,00 x 10-2 mol.L-1. Ce titrage est suivi par conductimétrie.
Protocole expérimental du titrage conductimétrique.
- Prélever un volume d’essai VESSAI = 10,0 mL de la phase hydroalcoolique de la lotion capillaire.
- Introduire la prise d’essai dans un bécher de 250 mL et ajouter environ 200 mL d’eau distillée.
- Remplir la burette graduée avec la solution titrante de nitrate d’argent.
- Installer le dispositif de suivi conductimétrique et d’agitation.
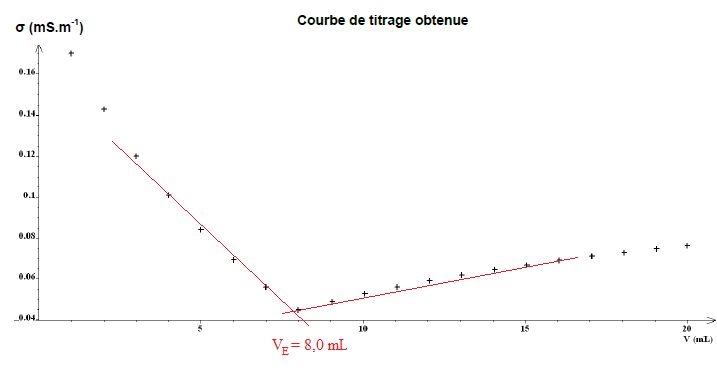
- Verser la solution de nitrate d’argent, millilitre par millilitre, dans le bécher et noter la valeur de la conductivité s du mélange réactionnel après chaque ajout.
- Tracer le graphe s
= f(V) montrant l’évolution de la conductivité du mélange réactionnel
en fonction du volume V de solution de nitrate d’argent versé.
Action des ions argent (I) sur les ions chlorure.
Lorsqu’on met en présence des ions argent (I) Ag+ et des ions chlorure Cl-
, il se produit une réaction de précipitation instantanée et totale
conduisant à la formation de particules solides de chlorure d’argent.
L’équation de la réaction modélisant cette transformation chimique
s’écrit : Ag+aq + Cl- (aq) --> AgCl(s).
Données :
masses molaires atomiques : M(Na) = 23,0 g.mol-1 ; M(Cl) = 35,5 g.mol-1 ; M(Ag) = 107,9 g.mol-1 ;
masse volumique de la phase hydroalcoolique de la lotion capillaire r = 975 g.L-1 ;
conductivités molaires ioniques à 25°C ( mS m2 mol-1 ) : l Na+ = 5,01 ; l Cl- = 7,63 ; l Ag+ = 6,19 ; l NO3- = 7,14.
3.1. Avec quelle verrerie a-t-on prélevé le volume d’essai VESSAI = 10,0 mL ?
Un volume précis est mesuré à l'aide d'une pipette jaugée de 10,0 mL dans ce cas.
3.2. Donner deux arguments pour justifier l’ajout d’environ 200 mL d’eau distillée à la prise d’essai.
L'extrémité de la sonde du conductimètre doit être correctement immergée.
Le volume de la solution reste pratiquement constant au cours du dosage.
3.3. Interpréter qualitativement le changement de pente observé sur le graphe s = f(V).
Avant l'équivalence, les ions argent sont en défaut. Du point de vue de
la conductivité, tout se passe comme si on remplaçait les ions chlorure
par des ions nitrate de conductivité molaire ionique moindre. La
conductivité de la solution décroît.
Après l'équivalence, on ajoute des ions argent et des ion nitrate : la conductivité de la solution croît plus rapidement.
3.4. Rappeler la définition de l’équivalence d’un titrage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
3.5. L’étiquette
d’un flacon de lotion capillaire indique un pourcentage massique en
chlorure de sodium voisin de 0,1 % dans la phase hydroalcoolique. Cette
information est-elle exacte ?
Quantité de matière d'ion chlorure à l'équivalence : n = VE C =8,0 *2,00 10-2 =0,16 mmol dans 10 mL de solution hydroalcoolique.
Masse de chlorure de sodium n M(NaCl) = 0,16 (23+35,5 )~9,4 mg .
Masse de 10 mL de solution hydroalcoolique : 10 *0,975 = 9,75 g.
Pourcentage massique en chlorure de sodium : 9,4 10-3 / 9,75 = 9,6 10-4 (0 ,096 % ~0,1 %).
L'information donnée dans le texte est exacte.
|
|