De la betterave
sucrière aux carburants.
Bac S Métropole 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
|
|
|
1.4. Les formes linéaires du D-Glucose et du D-Fructose sont-elles stéréoisomères ? Justifier.
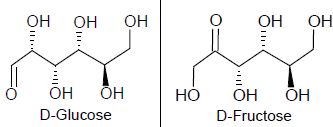
Ce ne sont pas des stéréoisomères, car ils ne possèdent pas la même formule semi-développée.
1.5 À partir de quelles formes cycliques du D-Glucose et du D-Fructose le saccharose est-il formé
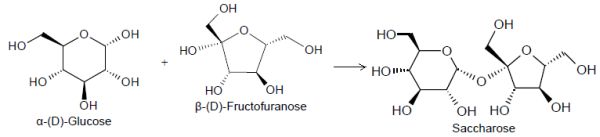
Le saccharose contenu dans 30 g de betterave sucrière est extrait avec
de l’eau grâce à un montage à reflux. À la fin de l’extraction, on
recueille une solution aqueuse S qui contient 5,8 g de saccharose.
1.6. L’eau est un solvant adapté à cette extraction. Proposer une explication à la grande solubilité du saccharose dans ce solvant.
Le saccharose possède un grand nombre de groupe hydroxyle. La liaison
OH est polarisée, l'atome d'oxygène plus électronégatif que
l'hydrogène, porte une charge partielle négative. Le saccharose est un
molécule polaire, soluble dans l'eau, solvant polaire. De nombreuses
liaisons hyfdrogène intermoléculaires peuvent s'établir entre les deux
espèces.
On hydrolyse ensuite, en milieu acide, le saccharose contenu dans la
solution S. L’hydrolyse peut être modélisée par une réaction d’équation
:
C12H22O11 (aq) + H2O (ℓ) --> C6H12O6 (aq) + C6H12O6 (aq)
saccharose + eau --> glucose +fructose.
On suppose que la transformation est totale, que l’eau est en excès et
qu’initialement la betterave ne contenait ni glucose ni fructose.
1.7. Émettre une
hypothèse sur le rôle de l’acide utilisé lors de cette hydrolyse et
proposer une expérience simple permettant de la tester.
L'acide joue le rôle de catalyseur.
Effectuer une hydrolyse avec puis sans acide et comparer les temps de demi-réaction.
Mesurer le pH initial du milieu réactionnel ainsi que le pH final.
Un catalyseur accélère une réaction thermodynamiquement possible, il
n'intervient pas dans le bilan, étant régénéré lors de la dernière
étape.
Si les deux valeurs du pH sont voisines et si il n'existe plus
de saccharose, alors cela prouve le rôle de catalyseur de l'acide.
On a réalisé la chromatographie du saccharose, du D-Glucose et du
D-fructose. Le chromatogramme obtenu est donné. Tous les
chromatogrammes sont supposés réalisés dans les mêmes conditions
expérimentalesque celui qui est photographié.
1.8. Représenter, l’allure du chromatogramme obtenu après élution et révélation, sachant que :
- le dépôt A est un échantillon du milieu réactionnel avant hydrolyse du saccharose ;
- le dépôt B est un échantillon du milieu réactionnel au cours de l’hydrolyse du saccharose ;
- le dépôt C est un échantillon du milieu réactionnel après hydrolyse complète du saccharose.
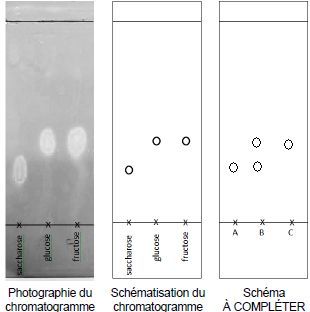
Initialement il n'y a que du saccharose ( A) ; en cours de réaction, il
reste du saccharose et il s'est formé du glucose et du fructose ( B) ;
à la fin il n'y a plus de saccharose.
|
|
|
|
2. Du saccharose au bioéthanol.
La fermentation alcoolique des jus sucrés sous l'action de
micro-organismes est une source de production d'alcools. Dans le cas de
la betterave sucrière, la solution de saccharose (jus sucré) extrait de
la betterave fermente pour produire de l’éthanol (bioéthanol) et du
dioxyde de carbone selon la réaction supposée totale d’équation :
C12H22O11(aq) + H2O(ℓ) → 4 C2H6O(aq) + 4 CO2(aq)
2.1. Écrire la formule semi-développée de l’éthanol.
CH3-CH2-OH.
2.2. Attribuer à la molécule d’éthanol l’un des deux spectres de RMN proposés ci-dessous. Justifier.
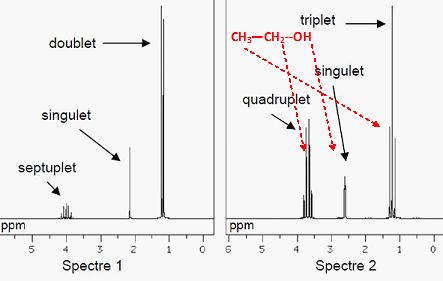
Source : National Institute of Advanced Industrial Science and Technology – http://sdbs.db.aist.go.jp
L'hydrogène de l'alcool n'est pas couplé avec les autres hydrogène : singulet.
Protons du groupe CH3 : l'atome de carbone voisin compte deux hydrogène, donc le signal est un triplet.
Protons du groupe CH2 : l'atome de carbone voisin compte trois hydrogène, donc le signal est un quadruplet.
2.3. Déterminer la masse d’éthanol obtenu par la fermentation du saccharose contenu dans une betterave sucrière de masse 1,25 kg.
30 g de betterave sucrière donne 5,8 g de saccharose.
1,25 kg de cette betterave donne : m=5,8 *1,25 / 0,030 = 2,42 102 g de saccharose.
Quantité de matière correspondante : n = m / M(saccharose) =242 / 342 = 0,7076 mol.
n(alcool) = 0,7076*4 =2,83 mol.
Masse d'éthanol = 4 n M(éthanol) = 2,83 *46 = 1,30 102 g.
|
3. Et si on roulait tous au biocarburant ?
L’objectif de cette partie est de déterminer la surface agricole à
mettre en culture avec de la betterave sucrière pour que la France
devienne autosuffisante en bioéthanol.
On fait l’hypothèse que la totalité du parc automobile utilise du
carburant contenant du bioéthanol obtenu à partir du saccharose extrait
de la betterave. Dans cette hypothèse, on estime que le volume de
bioéthanol nécessaire au fonctionnement du parc automobile pendant un
an est de l’ordre de 3 × 106 m3.
Montrer que la masse de betteraves sucrières qu’il faut pour produire ce volume de bioéthanol est de l’ordre de 2 × 107
tonnes. En déduire l’ordre de grandeur de la surface agricole
nécessaire à cette production de betteraves sucrières. Comparer avec la
surface agricole française cultivée de 2009.
Masse volumique de l'éthanol : r = 789 kg m-3.
Masse d'éthanol : m = 3 106 * 789 = 2,4 109 kg soit 2,4 109 /0,046 = 5,15 1010 mol.
Masse de saccharose : 5,15 1010 /4 *0,342 =4,4 109 kg.
Masse de betterave sucrières : 4,4 109*30 /5,8 = 2,3 1010 kg ~2 107 tonnes.
Rendement de la culture de betterave sucrière : 74,8 tonnes par hectare ;
surface cultivée en betterave sucrière : 2 107 / 74,8 = 3 105 ha.
Surface agricole française cultivée : environ 10 millions d’hectares ( 107 ha) ;
La culture de la betterave représenterait 3 % de la surface totale cultivée en France.
|
|