Sucre et
électrons. Bac S Centre étranger 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Depuis
10 ans, glucose, bactéries ou plantes inspirent les chercheurs en quète
d'une source d'énergie alternative et propre. En 2010, des chercheurs
ont ainsi réussi à mettre au point une pile uniquement alimentée par le
glucose de l'organisme. Ce dispositif de quelques millimètres permet au
dioxygène et au sucre présents dans différents liquides physiologiques
du corps de réagir. Cette réaction, qui génère des électrons, conduit à
la production de courant par la pile. Le procédé est basé sur
l'oxydation du glucose par le dioxygène, avec utilisation d'enzymes qui
recouvernt les électrodes. D'après le site www.lejournal.cnrs.fr.
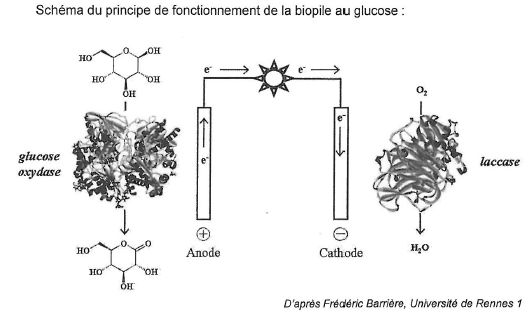
Réaction d'oxydation à l'anode : C6H12O6 --> C6H10O6 + 2H++2e-.
Réaction de réduction à la cathode : O2 + 4H++4e---> 2H2O.
1. Le glucose.
Le glucose existe dans la nature sous deux formes : une forme linéaire, le D-glucose, et deux formes cycliques : le a-D-glucopyranose et le ß-D-glucopyranose.
1.1. Forme linéaire du glucose
1.1.1. Identifier les groupes caractéristiques de cette molécules et nommer la fonction associée à chacun d'eux.
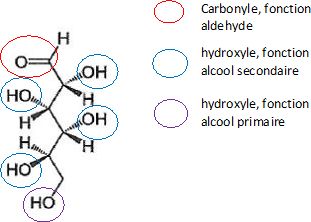
1.1.2. Identifier les atomes de carbone asymétriques.
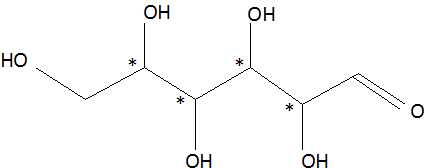
1.1.3.
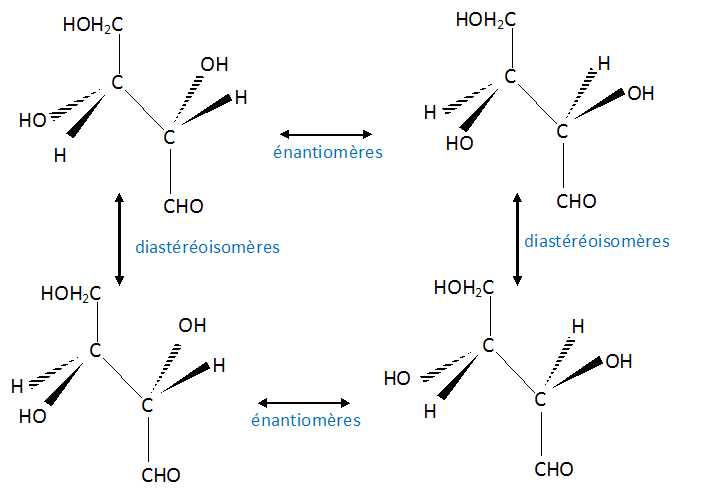
Deux stéréoisomères du glucose, le D- mannose et le D-galactose,
existent dans la nature. Sont-ils des énantiomères du D-glucose ?
Justifier.
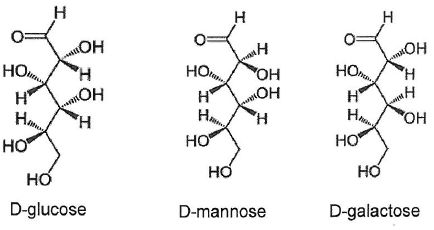
D-glucose et D-mannose sont diastéréoisomères ( seul le carbone n°2 change de configuration ).
D-glucose et D-galactose sont diastéréoisomères ( seul le carbone n°4 change de configuration ).
D-mannose et D-galactose sont diastéréoisomères ( seul le carbone n°4 change de configuration ).
|
|
|
1.2. Forme cyclique du glucose.
La représentation de Cram du ß-D-glucopyranose est donnée :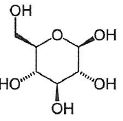
On donne les étapes du mécanisme de cyclisation permettant de passer de
la forme linéaire du D-glucose à la forme cyclique, le ß-glucopyranose.
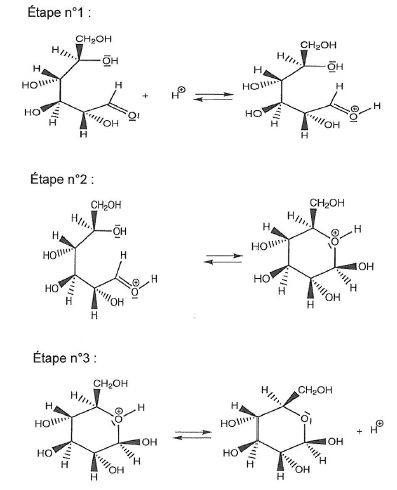
1.2.1 Identifier
le site donneur et le site accepteur mis en jeu lors de l'étape 2 et
représenter les flèches courbes rendant compte de cette étape.
Site donneur, riche en électrons, l'atome d'oxygène du groupe hydroxyle porteur de doublets non liants.
Site accepteur appauvri en électrons, carbone du groupe aldéhyde protoné.
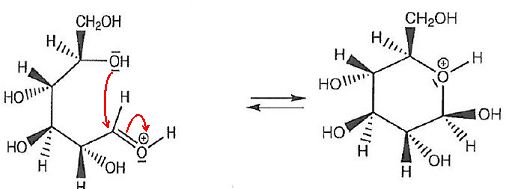
1.2.2. La cyclisation est d'autant plus rapide que la concentration en ion H+ est importante.
Peut-on considérer que cet ion est catalyseur de la réaction ? Justifier.
Cet ion accélère la réaction.
De plus il est consommé lors de la première étape et se trouve régénéré lors de l'étape 3.
C'est donc un catalyseur.
|
|
|
|
2. Rôle de l'enzyme glucose oxydase dans l'oxydation du glucose.
Pour illustrer les effets de cette enzyme, des élèves réalisent
quatre suivis cinétiques de l'oxydation du glucose par le dioxygène.
Ils réalisent quatre mélanges identiques de solution de glucose et de
dioxygène, le dioxygène étant le réactif limitant. Dans chaque mélange
l'enzyme est introduite à des concentrations différentes : c1 = c ; c2 = ½c ; c3 = 0,25 c ; c4 = 0,125 c où c est une concentration de référence de l'enzyme.
On donne les courbes donnant la concentration en dioxygène dans le milieu en fonction du temps pour chaque expérience.
2.1. Ecrire l'équation de la réaction d'oxydation du glucose par le dioxygène.
Réaction d'oxydation à l'anode : 2C6H12O6 --> 2C6H10O6 + 4H++4e-.
Réaction de réduction à la cathode : O2 + 4H++4e---> 2H2O.
Ajouter : 2C6H12O6 + O2 + 4H++4e- --> 2C6H10O6 + 4H++4e-+ 2H2O.
Simplifier : 2C6H12O6 + O2 --> 2C6H10O6 + 2H2O.
2.2. Quel est le rôle de la glucose oxydase dans la réaction d'oxydation du glucose par le dioxygène ?
Si la concentration en enzyme augmente, la vitesse de la réaction croît.
La glucose oxydase est une enzyme qui catalyse l'oxydation du glucose par le dioxygène.
2.3 Représenter
qualitativement l'allure de la courbe donnant l'évolution de la
concentration en dioxygène dans la solution en l'absence de glucose
oxydase.
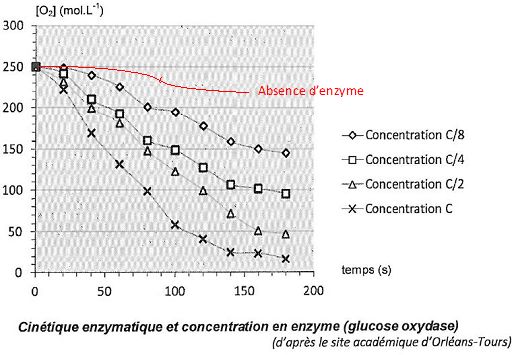
2.4. Comment évolue le temps de demi-réaction en fonction de la concentration en enzyme ? Justifier graphiquement.
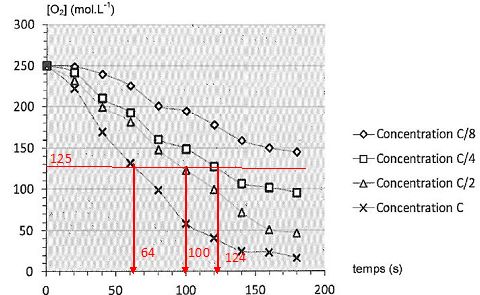
Le temps de demi-réaction croît si la concentration en enzyme diminue.
2.5. Dans la
biopile au glucose, l'oxydation du glucose a lieu à l'anode et la
réduction du dioxygène à la cathode. L'intensité du courant étant
d'autant plus grande que le débit en électrons dans le circuit est
important, que peut-on dire de l'évolution de l'intensité du courant en
fonction de la concentration en glucose oxydase ?
Si la concentration en enzyme croît, l'intensité du courant est
importante, mais diminue rapidement avec la consommation du dioxygène.
Si la concentration en enzyme est plus faible, l'intensité du courant sera plus petite, maid diminuera plus lentement.
2.6.
En réalité, l'enzyme est opérante uniquement sur la forme cyclique
principale du glucose, le ß-D-glucopyranose, et inopérante sur la forme
linéaire du glucose ou sur l'autre forme cyclique du glucose. Quelle
caractéristique de sa réactivité cela illustre-til ?.
L'enzyme est sélective ; l'oxydation du glucose par cette enzyme est stéréospécifique.
|
3. Durée de fonctionnement de biopiles.
L'obstacle majeur d'un développement à grande échelle des biopiles
reste leurs dimensions. Pour alimenter de gros appareils, il faut en
associer un grand nombre. Sony a commercialisé un lecteur MP3
névessitant une puissance d'alimentation de 150 mW, alimenté par une
pile composée de sucre et d'eau. La pile avait une longueur
d'environ 20 cm et une réserve de 100 g de glucose.
On donne :
énergie libérée par la réaction du glucose et du dioxygène dans la biopile : 150 kJ par mole de glucose oxydé ;
énergie E( J) reçue par le lecteur MP3 pendant la durée Dt( s) : E = PDt où P est la puissance d'alimentation en watt.
3.1. Déterminer la durée de fonctionnement du lecteur MP3 alimenté par la biopile.
Quantité de matière de glucose :m /M = 100 / 180 = 0,555 mol.
Energie disponible : 150*0,555 = 83,3 kJ.
Durée de fonctionnement : E / P = 83,3 103 / 0,150 ~5,56 105 s ( 152 heures ).
3.2. On trouve du
glucose dans les fruits, ce qui fait des jus de fruits un moyen de
recharger les biopiles. L'étude qui suit a pour objectif d'évaluer
l'énergie disponible dans une biopile au glucose rechargée avec un
litre de jus de raisin.
On introduit dans une fiole jaugée de 50 mL, 2,0 mL de jus de raisin et
20,0 mL d'une solution de diiode ( coloration jaune en milieu aqueux)
de concentration 2,0 10-2 mol/L. La fiole est complétée par
une solution d'hyudroxyde de sodium. La réaction qui se produit lors du
mélange a pour équation chimique :
I2 aq + 3HO- aq + RCHO aq --> RCOO-aq + 2H2O +2I-aq.
Les ions hydroxyde et le diiode sont introduits en excès.
Le glucose est noté RCHO.
Une fois la réaction terminée le diiode en excès est dosé par
spectrophotométrie, l'appareil est réglé à la longueur d'onde de 440
nm. La mesure de l'absorbance d'un échantillon de la solution
donne A = 1,6. Une courbe d'étalonnage a été tracée à cette longueur
d'onde à partir de quatre solutions de diiode de concentration connue.
Déterminer la durée de fonctionnement du MP3 alimenté par une pile au glucose composée d'un litre de jus de raisin.
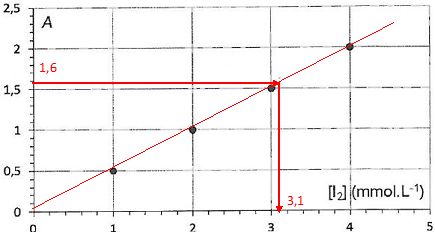
Concentration initiale du diiode après diution : 2,0 10-2 *20 /50 = 8,0 10-3 mol/L.
Quantité initiale de diiode : 50,0*8,0 10-3 =0,40 mmol.
Quantité de diiode en excès : 50*3,1 10-3 = 0,155 mmol.
Quantité de matière de diiode ayant réagi : 0,40-0,155 =0,245 mmol.
Quantité de matière de glucose dans 2,0 mL de jus de raisin : 0,245 mmol soit 0,1225 mol dans un litre de jus de raisin.
Energie libérée par l'oxydation du glucose = 0,1225 *150 =18,37 kJ.
Durée de fonctionnement : 18,37 103 / 0,150 ~ 1,2 105 s ( 34 heures.) .
|
|