Analyse
du sang par la méthode chimique de Cordebard.
Concours général Stl 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
L’éthanol
contenu dans le sang est séparé par distillation, en présence d’acide
picrique qui a une action défécatrice et antimousse. Le distillat est
recueilli dans une fiole jaugée contenant de l’eau
distillée et
placée dans un bain réfrigérant. La solution aqueuse d’éthanol est
alors mise en présence d’une solution nitrochromique (mélange d’acide
nitrique et de dichromate de potassium) à froid et en excès. L’excès
d’ions dichromate est dosé en retour par iodométrie. Un essai à blanc
est pratiqué en parallèle par remplacement de la solution aqueuse
obtenue à partir du distillat par de l’eau distillée.
Dosage de l’éthanol contenu dans le sang de Monsieur Blank.
On prélève un volume V0 = 5,00 mL de sang que
l'on dissout dans 75 mL d'acide picrique. On distille et on récupère un
volume V1 = 50,00 mL de distillat contenant la
totalité de l'alcool (le distillat est une solution aqueuse d’éthanol
appelée S1 dont la concentration molaire en
éthanol est notée C1). Dans un erlenmeyer, on
introduit des volumes V2 = 20,00 mL de distillat
et V3 = 10,00 mL d'un mélange nitrochromique de
concentration molaire C3 = 2,17×10-2
mol.L-1 en ions dichromate. On bouche
l’erlenmeyer et on laisse la réaction se dérouler 10 min, puis on
ajoute un volume V4 = 10,0 mL d'iodure de
potassium de concentration molaire C4, telle que
les ions iodure I- soient en excès. On dose le
diiode formé par une solution de thiosulfate de sodium de concentration
molaire C5 = 8,00×10-2
mol.L-1. Le volume versé pour atteindre
l'équivalence est V5 = 10,95 mL.
Essai à blanc : on répète la même opération avec 5,00 mL d'eau
distillée et 75 mL d'acide picrique. On traite le volume V'2
= 20,00 mL de distillat selon le même ordre opératoire. Le dosage du
diiode formé nécessite un volume V'5 = 16,25 mL
de thiosulfate de sodium pour atteindre l’équivalence.
Faire
un schéma annoté du montage de distillation.
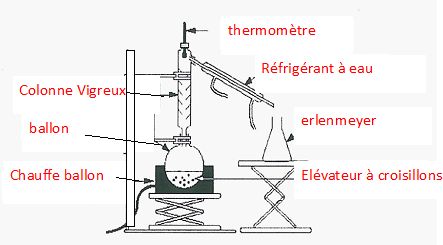
Écrire
l’équation de la réaction d’oxydation de l’éthanol par les ions
dichromate qui conduit à la formation de l’acide éthanoïque. En déduire
la relation entre la quantité de
matière
d’éthanol contenu dans la prise d’essai et la quantité de matière
d’ions dichromate ayant réagi avec l’éthanol.
3 fois{ C 2 H 6
O +H 2O= C 2H 4
O 2 + 4 électrons + 4H +}.
2 fois{Cr 2O 72-
+ 6 electrons +14 H +
= 2 Cr 3+ + 7 H 2O }.
3 C 2 H 6 O + 2Cr 2O 72-
+28 H + +3H 2O---> 3
C 2H 4 O 2
+ 4 Cr 3+
+ 12 H + + 14 H 2O.
3 C 2 H 6 O + 2Cr 2O 72-
+16 H + ---> 3 C 2H 4
O 2 + 4 Cr 3+ + 11
H 2O. n(alcool) =1,5 n(Cr 2O 72-).
Justifier,
sans calcul, le sens d'évolution de cette réaction.
L'ion dichromate est l'oxydant le plus fort ; l'éthanol est le
réducteur le plus fort..
Pourquoi,
pour doser l’éthanol, est-il nécessaire d’utiliser les ions dichromate
en excès ?
Il ne faut pas s'arrêter au stade éthanal ; tout l'éthanol doit être
oxydé en acide éthanoïque, d'où l'excès d'oxydant.
Déterminer
la relation entre la quantité de matière de diiode formé et la quantité
de matière d’ions dichromate introduite en excès (ions dichromate
n’ayant pas réagi avec l’éthanol).
Cr 2O 72-
+ 6 e - +14 H +
= 2 Cr 3+ + 7 H 2O.
3 fois{2I -
= I 2 +2e -}.
Cr 2O 72-
+ 6 I - +14 H +
= 2 Cr 3+ +3I 2 +7 H 2O.
n (I 2)=3 n(Cr 2O 72-) excès.
|
| .
. |
|
|
De
même, exprimer la relation entre la quantité de matière d’ions
dichromate en excès et la quantité de matière d’ions thiosulfate
introduite à l’équivalence.
I2 +2e-= 2I-.
2S2O32- = S4O62- + 2e-.
I2 +2S2O32- = S4O62- +2I-. n(I2) =½n(S2O32-). Par suite : 3
n(Cr2O72-)excès =½n(S2O32-) ;
n(Cr2O72-)excès
=n(S2O32-) / 6 = C5(V'5-V5)/6 =8,00 10-2*5,3 /6=7,067 10-2 mmol.
En
déduire la relation entre la quantité de matière totale d’ions
dichromate, la quantité de matière d’éthanol contenue dans le volume V2 de
distillat et la quantité de matière d’ions thiosulfate introduite à
l’équivalence.
n(Cr2O72-) totale
=n(S2O32-) blanc/ 6 =C5V'5/6=8,00 10-2*16,25 /6=0,2167
mmol.
n(Cr2O72-) oxydant
l'alcool =n(Cr2O72-) totale
- n(Cr2O72-)excès =C5V'5/6-C5V5/6 =C5(V'5-V5)/6
=0,2167-7,067 10-2 =0,146 mmol.
n(alcool)
=1,5n(Cr2O72-) oxydant
l'alcool =1,5 C5(V'5-V5)/6=C5(V'5-V5)/4=0,080(16,25-10,95)
/4 =0,106 mmol.
|
.
|
|
Déterminer
la concentration molaire puis la concentration massique de la solution
aqueuse d’éthanol S1.
0,106 mmol d'éthanol dans V2=20 mL soit : C1=C5(V'5-V5)/(4V2)=0,106/20
= 5,3 10-3 mol/L ou 5,3 10-3
*46,0 =0,2438 ~ 0,244 g/L.
En déduire
la concentration massique en éthanol dans le sang prélevé.
V1C1 =50 * 5,3 10-3
=0,265 mmol d'éthanol dans 5 mL de sang soit : 0,265/5=5,3 10-2
mol/L ou 5,3 10-2*46 =2,44 g/L.
Quel est
l’intérêt expérimental majeur de cet essai à blanc ?
Cela évite de connaître la concentration en ion dichromate, qu'elle
soit précise ou non.
|
|
|