L'acide
ascorbique.
Concours technicien police technique et scientifique 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
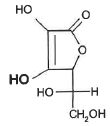
L'acide
ascorbique ( vitamine C) ne comporte pas de groupement acide
carboxylique mais une fonction énol ( représentée en gras sur le schéma
ci-dessous) de pKa = 4,2. On notera pour simplifier ROH la
forme acide et RO- la forma basique.
On dilue de l'acide ascorbique dans l'eau
de façon à obtenir une solution à 0,1 mol/L en acide ascorbique. Ecrire
les différents équilibres chimiques qui s'établissent dans cette
solution aqueuse.
H3O+aq
+ HO-aq = 2H2O(l)
; Ke = 10-14.
ROHaq + H2O
(l) = RO-aq + H3O+aq ; Ka
= [RO-aq][H3O+aq] / [ROHaq].
Calculer le pH de cette solution.
|
Avancement
volumique ( mol/L)
|
ROHaq |
+ H2O (l) |
= RO-aq |
+ H3O+aq |
Initial
|
0
|
0,1
|
Solvant
|
0
|
0
|
en
cours
|
x
|
0,1-x
|
x
|
x
|
A
l'équilibre
|
xéq
|
0,1-xéq
|
xéq |
xéq |
Ka = x2éq
/ (0,1-xéq) = 10-4,2 =6,31 10-5.
x2éq +6,31 10-5 xéq -6,31 10-6=0.
Discriminant D =
2,52 10-5 ; D½
=5,0243 10-3 ;
xéq=½(-6,31 10-5 +5,0243 10-3)=2,48 10-3.
pH = - log(2,48 10-3) =2,61 ~2,6.
On mesure le pH d'une solution d'acide
ascorbique, la valeur indique pH = 3,1. Quel type d'électrode
utiliseriez-vous pour mesurer le pH de la solution ?
L'électrode
de verre, électrode de mesure est sensible à la concentration aux ions
oxonium ; l'autre électrode sert de référence. L'électrode combinée
mesure Everre - Eréférence et traduit cette différence
en unité pH grâce à l'étalonnage préalable à partir de deux solutions
tampon étalon à températaure donnée.
Déterminer la quantité en % massique
d'acide ascorbique contenue dans cette solution. On supposera que la
densité de la solution est d=1.
Ka = x2éq
/ (0,1-xéq) = 10-4,2 =6,31 10-5 avec xéq = 10-pH = 10-3,1
=7,94 10-4 mol/L.
C-xéq =x2éq / Ka ; C = xéq (1+xéq / Ka )= 7,94 10-4 (1+ 7,94 10-4/(6,31 10-5 ))=1,08 10-2 mol/L.
M( acide ascorbique ) = 176 g/mol.
Masse d'acide ascorbique dans 1 L de solution : 1,08 10-2 *176 =1,9 g ou ~0,2 %.
|
| .
. |
|
|
On dissout un comprimé de 500 mg de vitamine C dans 100 mL d'eau. Le pH
obtenu est de 4,5. La forme commerciale étant tamponnée, le comprimé
est constitué d'acide ascorbique ( ROH) et d'ascorbate de sodium (
RONa). Donner en la démontrant l'expression littérale qui permet de
déterminer le pH d'une solution contenant un mélange d'acide ascorbique
à la concentration C1 et d'ascorbate de sodium à la
concentration C2. On fera l'hypothèse qu'à l'équilibre [HO-]
et [H3O+] sont négligeable devant C1
et C2.
C2
= [RO-aq] en négligeant la réaction de l'ion
ascorbate avec l'eau.
C1 = [ROH aq] en négligeant l'action de l'acide ascorbique
avec l'eau.
Ka = [RO-aq][H3O+aq] / [ROHaq]
= C2 [H3O+aq] / C1.
[H3O+aq] = Ka C1 / C2 ; log [H3O+aq] = log Ka+log(C1 / C2).
pH = pKa + log (C2 /
C1).
Rappeler les propriétés d'une solution
tampon.
Une solution tampon
modère les variations de pH suite à l'ajout modéré d'une base forte ou
d'un acide fort et lors d'une dilutuion modérée.
Calculer les masses respectives d'acide ascorbique et d'ascorbate de
sodium dans un comprimé de 500 mg.
m : masse d'acide
ascorbique et 500-m : masse d'ascorbate de sodium.
M ( acide ascorbique) =
176 g/mol ; M(ascorbate de sodium) = 198 g/mol.
C1
= m / 176 ; C2 =( 500-m) / 198 ; C2 / C1 =0,889 (500 / m -1).
log (C2 / C1) =pH-pKa = 4,5-4,2 = 0,3 ; C2 / C1 ~2.
0,889 (500
/ m -1) = 2 ; 500 / m = 3,24 ; m =154 mg et 346 mg d'ascorbate de sodium.
|
.
|
|
Le jus de pamplemousse frais contient de la
vitamine C et de l'acide picrique. On dose les acides présents dans ce
jus par la soude.
L'acide citrique est un triacide R(CO2H)3
: pKa1 = 3,10 ; pKa2 = 4,80 ; pKa3 =
6,40.
Ecrire les réactions de dosage. Calculer
la valeur des constantes d'équilibre des réactions de dosage et
vérifier que ces réactions peuvent être considérées comme totales.
ROHaq + HO-
aq ---> RO-aq + H2O(l).
K1 = [ RO-aq] / ([ROHaq][HO-
aq])=Ka
/ Ke = 10-4,2 / 10-14 = 109,8
~6,3 109.
R(CO2H)3
aq+ HO- aq ---> R(CO2H)2 (CO2-)aq + H2O(l).
K2
= [ R(CO2H)2 (CO2-)aq] / ([R(CO2H)3
aq][HO-
aq])=Ka1
/ Ke = 10-3,1 / 10-14 = 1010,9
~7,9 1010.
R(CO2H)2 (CO2-)aq+ HO- aq ---> R(CO2H) (CO2-)2aq + H2O(l).
K3=
[ R(CO2H) (CO2-)2aq] / ([R(CO2H)2 (CO2-)aq][HO-
aq])=Ka2
/ Ke = 10-4,8 / 10-14 = 109,2
~1,6 109.
R(CO2H) (CO2-)2 aq+ HO- aq ---> R (CO2-)3 aq + H2O(l).
K4=
[ R (CO2-)3 aq] / ([R(CO2H) (CO2-)2 ][HO-
aq])=Ka3
/ Ke = 10-6,4 / 10-14 = 107,6
~4 107.
Ces constantes étant grandes, les réactions sont totales.
Les acidités seront-elles dosées séparément ?
Non, les pka
sont trop proches les uns des autres.
On dose par HPLC la vitamine C et l'acide
picrique contenus dans le jus de pamplemousse. Les données sur le
chromatogramme sont les suivantes :
colonne : Polaris C18-A ( 4,6 x 250 mm, 5µm ) ; échantillon : dilué 50
fois dans l'éluant ; phase mobile :eau/acétonitrile tamponnée à pH =
2,10 ; débit : 0,5 mL / min ; détecteur UV à 220 nm.
Rappeler brièvement, en trois lignes maximum, le principe de l'HPLC.
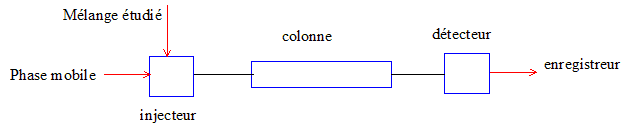
A l'instant initial,
le mélange à séparer est injecté à l'entrée de la colonne où il se
dilue dans la phase mobile qui l'entraîne à travers la colonne. Si la
phase stationnaire a été bien choisie, les constituants du mélange,
appelés généralement les solutés, sont inégalement retenus lors de la
traversée de la colonne.
De ce phénomène appelé
rétention il résulte que les constituants du mélange injecté se
déplacent tous moins vite que la phase mobile et que leurs vitesses de
déplacement sont différentes. Ils sont ainsi élués de la colonne les
uns après les autres et donc séparés.
La colonne greffée C18 est(elle polaire ou apolaire ?
Les groupes alkyles
greffés sur la phase stationnaire comptent 18 atomes de carbone. La
colonne est apolaire.
Que représentent les
valeurs indiquées pour la colonne ?
4,6 : diamètre
interne ; 250 mm : longueur ; 5 µm : granulométrie.
Pourquoi travaille-t-on à un pH voisin de 2,1 ?
A pH inférieur à pKa-1,
la forme acide prédomine pour l'acide ascorbique et pour l'acide
picrique.
Citer un autre type de détecteur.
Réfractomètre
différentiel, électrochimique, fluorimétrique.
|
|
|