Synthèses de
l'anhydride
éthanoïque et de l'aspirine ;
concours inspecteur dgccrf 2014.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Synthèse anhydride éthanoïque.
On
étudie la synthèse de l'anhydride éthanoïque à partir de l'acétone avec
production intermédiaire de cétène. Ce premier réacteur est le siège de
deux réactions :
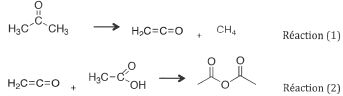
Tout le cétène présent après la réaction (1) est transformé en
anhydride éthanoïque grâce à la réaction (2).
1.1. Le réacteur 1
est alimenté avec un important excès d'acétone ( 100 kmol / h). La
composition molaire du méthane dans les effluents est de 9 %.
Déterminer les débits et compositions des effluents et le taux de
conversion de l'acétone après la réaction (1).
|
Avancement
(kmol /h)
|
acétone
|
=
cétène
|
+
méthane
|
Initial
|
0
|
100
|
0
|
0
|
Final
|
x
|
100-x
|
x
|
x
|
Nombre
total de moles à l'état final : 100+x.
Fraction molaire du méthane = fraction molaire cétène = x / (100+x) =
0,09.
x =9+0,09 x ; x = 9 / 0,91 =9,9.
Méthane : 9,9 % , débit : ~9,9 kmol/h ; cétène :
9,9 % , débit : ~9,9 kmol/h.
Acétone : 80,2 %, débit 80,2 kmol/h, taux de conversion : ~ 0,10.
1.2.
L'acétone est disponible liquide à 25°C. les effluents sortent du
réacteur à 950 K et le réacteur fonctionne à la pression atmosphérique.
Calculer l'enthalpie de la réaction (1) à 950 K. Comment est
cette réaction thermiquement ?
DH~
DH°f(cétène)
+ DH°f(méthane)-
DH°f(acétone)
.
DH~(-14,6) +
(-17,9)-(-51,8)~19 kcal/mol.
Cette réaction endothermique est favorisée, à pression constante, par
une augmentation de température.
2.1.
Les effluents du réacteur (1) arrivent dans un deuxième réacteur siège
de la réaction (2). Le débit molaire du cétène arrivant dans ce second
réacteur est 9,9 kmol/h. Celui-ci réagit totalement avec l'acide
acétique qui est en excès. Les effluents de ce second réacteur ont une
composition en acide acétique de 0,40 ( molaire). Calculer les
compositions et débits des effluents du réacteur ainsi que le débit
d'alimentation en acide acétique.
|
Avancement
(kmol /h)
|
cétène
|
+acide
acétique
|
=
anhydride acétique
|
Initial
|
0
|
9,9
|
n
|
0
|
Final
|
x
|
9,9-x
= 0
( x = 9,9)
|
n-x=
n-9,9
|
x
|
Nombre
total de moles à l'état final : n+9,9+x = n.
Fraction molaire de l'acide
acétique = (n-9,9) / n = 0,40 ; n =16,5 kmol/h.
Composition des éffluents : cétène : 0 ( réaction totale et réactif en
défaut).
Anhydride acétique : 9,9 kmol / h ; 9,9 / 16,5 =0,6 ( 60 %).
Acide acétique : 6,6 kmol / h ; 6,6 / 16,5 =0,4 ( 40 %).
2.2.
Montrer que la production en anhydride éthanoïque est voisine de 1010
kg / h.
M( anhydride éthanoïque ) =0,102 kg/mol.
m = n M =9,9 103 *0,102 ~1010 kg / h.
|
| .
. |
|
|
Synthèse aspirine.
La mise au
point industrielle a été effectué dans un réacteur pilote ( taille 1/4
de grand). Les dimensions de ce réacteur sont telles que le mélange
réactionnel occupe un volume de 1 m3.
1. Etude cinétique préliminaire.
A + B ---> D + E. (1)
1.1. Donner la relation qui lie la vitesse de formation de D et la vitesse de disparition de A.
vD = d[D] / dt ; vA = -d[A] / dt ; vD = - vA.
1.2. Donner la relation entre la vitesse v de la réaction et la vitesse de formation de D.
v = 1 / g d [x]/dt.
x avancement volumique et g coefficient stoechiométrique positif pour les produits et négatif pour les réactifs.
Dans le cas présent, tous les coefficients stoechiométriques valent ±1 ; [x]= [D] et [A] = [At=0]-[x]
v = vD ; vA = -d[A] / dt = d [x]/dt = v.
1.3. La vitesse de réaction peut avoir une expression de la forme : v = k[A]a [B]b.
a et b sont des nombres réels et k la constante de vitesse de la réaction.
Ecrire l'expression de la vitesse de la réaction (1) si elle admet des
ordres partiels égaux à 1 pour chaque réactif. Quel est l'ordre global
de la réaction ?
v = k [A]1 [B]1= k[A][B].
L'ordre globale de la réaction vaut 1+1 = 2.
1.4. Dans kle cas d'une réaction renversable conduisant à un équilibre, il y a superposition de deux réactions.
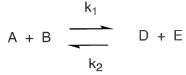
Donner la relation qui lie d[D]/dt aux concentrations si les réactions
directe et inverse admettent des ordres partiels égaux à 1 par rapport
à chaque réactif.
d[D]/dt = k1[A][B] - k2[D][E].
|
|
|
|
Détermination du temps de séjour dans le réacteur.
On
alimente le réacteur avec 10 moles d'acide salicylique et 20 moles
d'anhydride acétique. Le toluène, utilisé comme solvant ne participant
pas à la réaction, est ensuite introduit jusqu'à atteindre un volume
réactionnel V= 10 L =0,01 m3. Une faible quantité d'acide sulfurique ( catalyeur ) est ajoutée.
2.1. Déterminer à l'instant t les concentrations ( mol m-3)
des réactifs et des produits en fonction du taux de conversion X
de la réaction. X = quantité de réactif ayant réagi / quantité initiale
de réactif limitant.
| A
acide salicylique | + B
anhydride acétique | D
aspirine | + E
acide éthanoïque | | initial | 10 | 20 | 0 | 0 | | en cours | 10(1-X) mol | 20-10X mol | 10 X mol | 10X mol | 10(1-X) /V =
103(1-X) mol m-3 | (2-X) 103 mol m-3 | X 103 mol m-3 | X 103 mol m-3 |
2.2. Exprimer la vitesse v de formation de l'aspirine en fonction du taux de conversion X. Calculer le temps de séjour.
k1 = 3 10-7 m3 mol-1 s-1 ; k2 = 1 10-7 m3 mol-1 s-1.
v = k1[A] [B] -k2[D][E] =106( k1(1-X) (2-X) -k2 X2 )
v = 0,3(1-X) (2-X) -0,1 X2 =0,2 X2 -0,9 X + 0,6.
v = d[D]/dt =103 dX/dt =0,2 X2 -0,9 X + 0,6.
dt = 103 dX / (0,2 X2 -0,9 X + 0,6); intégrer entre 0 et X.
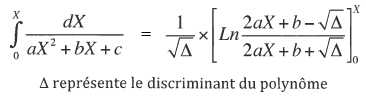
D = b2-4ac =0,92 -4*0,2*0,6 = 0,33 ; D½ ~0,574.
Pour un taux de conversion X = 0,8 :
2aX+b-D½ ~0,4 *0,8 -0,9-0,574 = -1,154 ; 2aX+b+D½ ~0,4 *0,8 -0,9+0,574 = -0,006 ;
ln[-1,154 / (-0,006) ]= 5,26.
b-D½ ~ -0,9-0,574 = -1,474 ; b+D½ ~ -0,9+0,574 = -0,326 ; ln[-1,474 /(-0,326)]=1,509.
t = 103 / 0,574 (5,26-1,509) = 6535 s ~1,8 heures.
Dimensionnement du réacteur industriel.
3.1. Pour
X = 0,8, pour une production de 144 kg d'aspirine par passe dans le
réacteur, calculer le volume total du réacteur industriel. Le volume du
mélange réactionnel occupe les 4 / 5 du volume total du réacteur.
Quantité de matière d'aspirine : 144 / M(aspirine) = 144 / 0,180 = 800 moles.
Quantité de matière initiale d'acide salicylique : 1000 moles.
Quantité de matière initiale d'anhydride éthanoïque : 2000 moles.
Quantité de matière finale d'acide salicylique : 200 moles.
Quantité de matière finale d'anhydride éthanoïque : 1200 moles.
Volume de toluène : 1 m3.
Le milieu réactionnel occupe un volume de 0,01 m3 pour 10 moles d'acide salycilique soit 1 m3 pour 1000 moles d'acide salicylique.
Volume total du réacteur industriel : 1,25 m3.
|
|
|
|