|
Exercice 9.
Ecrire à l'aide des formules semi-développées la demi-équation associée au couple acido-basique acide ascorbique / ion ascorbate.
Dans la suite, on notera AH l'acide ascorbique et A-
l'ion ascorbate. On souhaite déterminer la teneur en acide ascorbique
d'un comprimé de vitamine C. Le pH initial de la solution S d'acide
ascorbique est pH = 3,2. pKa( AH / A-) = 4,1.
On dissout un comprimé de vitamine C 500 mg finement broyé
dans de l'eau et on ajuste le volume à 100 mL ( fiole jaugée ) On
obtient la solution S. Celle-ci est titrée avec de l'hydroxyde de
sodium à c
= 0,20 mol/L. Quelle est l'espèce prédominante dans la solution S ?
A pH inférieur à pKa, la forme acide AH prédomine.
Ecrire l'équation de la réaction de l'acide ascorbique avec l'hydroxyde de sodium.
AH aq + HO-aq ---> A-aq + H2O(l).
Donner les coordonnées du point d'équivalence.
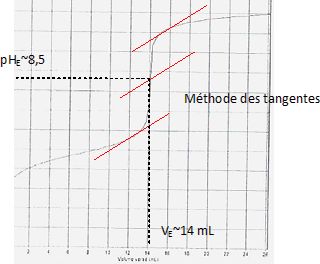
Quelle est la quantité de
matière d'acide ascorbique dans la solurion S ? En déduire la masse
d'acide ascorbique dans un comprimé. M( acide ascorbique) =176 g/mol.
n = cbVE = 0,20 *14 =2,8 mmol.
n M = 2,8*176 ~493 ~4,9 102 mg.
|