QCM
: chimie.
Concours kiné Ceerrf 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
1. Deux
atomes dont les noyaux sont 126C
et 14ZX ont les même
propriétés chimiques.
Parmi les affirmations suivantes, combien sont fausses ? 2.
- Les deux atomes se
trouvent dans la même période du tableau périodique. Vrai.
Ce sont deux
isotopes Z = 6 et X est le carbone.
-
Les
deux atomes se trouvent dans la même colonne du tableau périodique.
Vrai.
-
Z est inférieur à 6. Faux.
-
Z = 6.
Vrai.
-
Z est supérieur à 6.
Faux.
2. Une
solution aqueuse incolore S0 d'acide méthanoïque
présente un pH de 3. Une solution S1 est obtenue
en diluant 10 fois la solution S0 avec de l'eau.
On donne pKa ( acide méthanoïque / ion
méthanoate ) =3,7.
- L'acide
méthanoïque a pour formule brute C2H4O2.
Faux.
HCOOH.
-
La
concentration en ion HO- dans la solution S0
est nulle. Faux.
[HO-] = 10-14 / 10-pH = 10-11 mol/L.
-
Le pH de la solution S1 est supérieur à
3.
Vrai.
-
Le pKa du couple acide méthanoïque / ion
méthanoate est inférieur à 3,7 dans la solution S1,
car la dilution favorise la dissociation de l'acide. Faux.
Le pKa ne dépend que de la température.
-
Aucune des affirmations précédentes n'est correcte.
Faux.
3.
On plonge dans 100 mL d'une solution contenant des ions Fe3+
à une concentration c =2,0 10-2 mol/L, un
morceau de cuivre métallique de masse m =6,35 10-2
g. Une analyse chimique après réaction, supposée totale, met en
évidence la présence d'ions ferreux Fe2+ et
d'ion cuivre (II) Cu2+ dans la solution. M(Cu)
=63,5 g/mol.
- L'équation chimique de la réaction s'écrit : Cu2+aq
+2Fe2+aq ---> Cu(s) +2Fe3+aq.
Faux.
Cu(s)
+2Fe3+aq --->Cu2+aq +2Fe2+aq.
- Au cours de la réaction, l'oxydant est l'ion Cu2+aq
et le réducteur est l'ion Fe2+aq.
Faux.
Fe3+aq est l'oxydant et Cu(s) est le
réducteur.
- La solution finale est une solution tampon. Faux.
- L'avancement maximal est xmax = 2,0 10-3
mol. Faux.
|
Avancement
(mol) |
Cu(s) |
+2Fe3+aq |
--->Cu2+aq |
+2Fe2+aq |
| initial |
0 |
6,35 10-2
/ 63,5
=1,0 10-3 |
2 10-2
*0,1
= 2,0 10-3 |
0 |
0 |
| final |
xmax |
1,0 10-3-xmax |
2,0 10-3
-2xmax |
xmax |
2xmax |
Si
Cu(s) est en défaut : 1,0 10-3-xmax=0
; xmax=
1,0 10-3 mol.
Si Fe3+aq
est en défaut : 2,0 10-3
-2xmax=0
; xmax=
1,0 10-3 mol ( à retenir ).
-
Tout le cuivre a été consommé. Vrai.
-
Aucune des affirmations précédentes n'est correcte.
|
| .
. |
|
|
4.
Le spectre infrarouge d'un composé organique A, de formule brute C3H7NO
est donné ci-dessous :
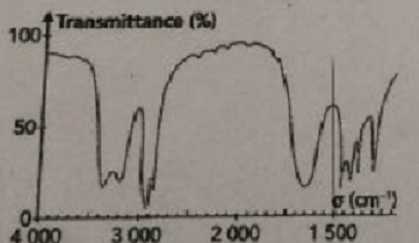
Le composé A possède des liaisons Ctét-H (
l'atome de carbone est tétragonal), C=O et N-H.
En infrarouge, la liaison N-H donne une bande pour N-H et deux bandes
pour NH2.
Le composé A est un amide.
- Il existe cinq isomères d'amide de formule C3H7NO.
Faux.
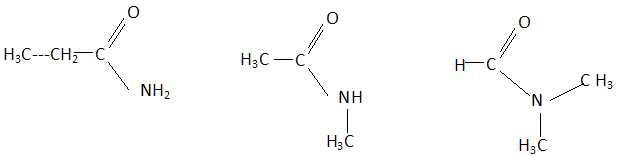
- Le N,N-diméthylméthanamide ne
peut pas avoir le spectre proposé. Vrai.
Le spectre
présente deux bandes vers 3300 cm-1, liaisons NH2.
- La bande vers 1650 cm-1 correspond à celle
d'une cétone. Faux.
C=O du
groupe amide..
- La bande à 3200 cm-1
et à 3400 cm-1 correspond à la liaison O-H lié.
Faux.
Liaisons NH2.
- A est le N-méthyléthanamide..
Faux.
-
Aucune proposition ne convient. Faux.
.
|
.
|
|
5. Le
nombre de molécules parmi celles proposées ci-dessous :
méthanal,
éthanol, éthène, acide éthanoïque, éthanal,
pouvant exister sous différentes conformations est de :
1 ; 2 ; 3 ;
4 ; 5 ; autres.
Méthanal H2C=
O, éthène H2C=CH2
: une seule conformation possible, pas de rotation possible
autour de la liaison double.
Ethanol CH3-CH2OH,
acide éthanoïque CH3-COOH, éthanal CH3-CHO
: plusieurs conformations par rotation autour de la liaison simple C-C.
6.
On introduit une masse m = 62,4 mg de sulfate d'argent dans un volume V
= 100 mL d'eau distillée. On suppose le volume constant lors de la
dissolution du soluté et la dissolution est totale. On introduit une
masse m' =1,27 g de cuivre en poudre dans la solution précédente. On
constate que la solution passe de l'incolore au bleu.
Couples redox : Cu2+/Cu ; Ag+
/ Ag. M(Cu) =63,5 g/mol ; M(Ag) =108 g/mol ; M(Ag2SO4)
=312 g/mol.
A la fin de la réaction ( supposée totale ), la concentration en ions
responsables de la couleur de la solution finale est ( en mol/L) :
1,0 10-4 ; 2,0 10-4 ; 4,0
10-4 ; 1,0 10-3 ; 4,0 10-3
; aucune valeur correcte.
|
avancement
(mol) |
2Ag+aq |
+ Cu(s) |
=2Ag(s) |
+Cu2+aq |
| Initial |
0 |
2*0,0624
/ 312
= 4,0 10-4. |
1,27
/63,5
=2,0 10-2 |
0 |
0 |
| Finale |
x |
4,0 10-4
-2x |
2,0 10-2
-x |
x |
x |
Si Cu(s) est en défaut : 2,0 10-2 -x =0 ; x =2,0
10-2 mol.
Si Ag+aq est en défaut : 4,0 10-4
-2x = 0 ; x = 2,0 10-4 mol ( on retient cette
valeur ).
n(Cu2+aq) finale = 2,0 10-4
mol dans 0,100 L ; [Cu2+aq]finale=2,0
10-4 /0,10 = 2,0
10-3 mol / L.
|
|
|
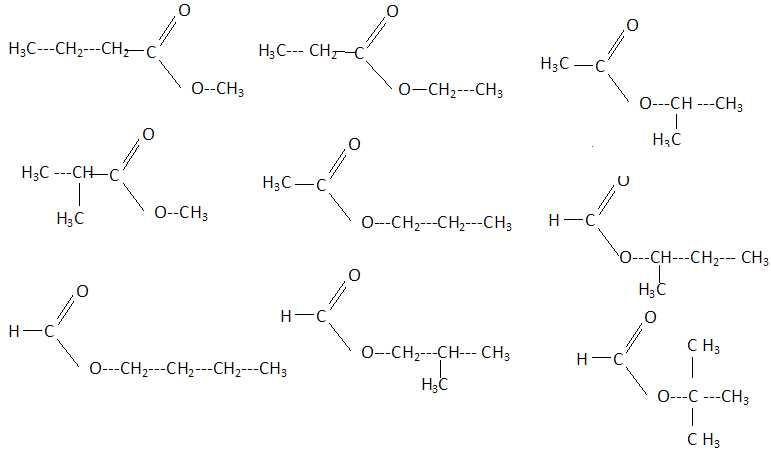
7. Il existe un
ensemble de x esters non cycliques, de masse molaire M = 102 g/L, ne
possédant aucune liaison multiple carbone- carbone et qui sont tous
isomères de constitution les uns des autres.
x a pour valeur : 3, 4, 6, 7, 9,
aucune valeur correcte.
CnH2nO2.
M = 12n +2n +32 = 102 soit n = 5 ; C5H10O2.
8. On dose par
titrage pH-métrique une solution SA d'acide
éthanoïque par une solution SB de soude de
concentration CB. pKa (
acide éthanoïque / ion éthanoate) = 4,8.
- La courbe obtenue présente deux points d'inflexion car on dose un
acide fort par une base faible. Faux.
La courbe
obtenue présente deux points d'inflexion car on dose un acide faible
par une base forte.
- On peut ajouter de l'eau distillée au cours du dosage, cela ne
modifie pas son résultat. Vrai.
L'eau
distillée n'apporte pas d'ion oxonium ni d'ion hydroxyde.
- A la demi-équivalence du dosage on aura pH = 2,4. Faux.
A la
demi-équivalence pH = pKa=4,8.
- A la fin du dosage le pH du mélange obtenu aura pour expression pH =
- log CB. Faux.
- A la fin du dosage le pH du mélange obtenu aura pour expression pH =
pKe+ log CB. Faux.
- Aucune des informations précédentes n'est correcte.
9. A propos de l'acide 2-aminobutanoïque.
- Ce composé possède une groupe carboxylique et un groupe amine. Faux.
H3C-CH2-CH NH2-COOH. groupe carboxyle.
Ce composé comme tous les acides a-aminés appartient à un couple de deux énantiomères. Faux.
La glycine H2N-CH2-COOH ne possède pas de carbone asymétrique.
- Le spectre RMN de ce composé présente un quintuplet. Vrai.
- Le spectre RMN de ce composé présente 5 signaux de multiplicité toutes différentes. Vrai.
- Aucune des informations précédentes n'est correcte.
10.
On considère un mélange à volume égaux d'acide nitrique et d'acide
chlorhydrique ( les deux solutions ayant initialement la même
concentration c ). Le pH du mélange est égal à 2,0.
Pour déterminer la concentration en ion chlorure du mélange, on fait réagir un volume V1 = 20,0 mL de ce mélange en ajoutant progressivement une solution de nitrate d'argent de concentration c2 = 2,0 10-2 mol/L, en présence d'un indicateur de fin de réaction permettant de déceler l'équivalence. Il faut verser un volume V2 de nitrate d'argent pour obtenir l'équivalence.
- c = 1,0 10-2 mol/L. Vrai.
On mélange V mL d'acide
nitrique de concentration molaire c et V mL d'acide chlorhydrique de
concentration molaire c ; quantité de matière d'ion oxonium dans le
mélange 2 VC ; volume du mélange 2V ;
[H3O+aq] = 2VC / (2V) = c ; pH = log c = 2 ; c = 1,0 10-2 mol/L.
- c = 2,0 10-2 mol/L. Faux.
- Le nitrate d'argent réagit avec les ions chlorure venant de l'acide nitrique. Faux.
Les ions chlorure proviennent de l'acide chlorhydrique.
- V2 = 10 mL. Faux.
A l'équivalence V1 c/2 = V2c2 ; V2 =0,5*20,0 *1,0 10-2 / (2,0 10-2) =5 mL.
- Le dosage réalisé ne sera pas qualifié de dosage par titrage car il
utilise un indicateur coloré pour repérer l'équivalence. Faux.
|
|
|