QCM :
énantiomères, RMN, avancement d'une réaction.
Concours kiné Berck 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
1. On considère les
deux structures moléculaires de l'acide lactique :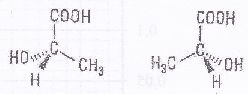
Combien y a t-il d'affirmations exactes ? 2.
- Ces deux structures ont la même
formulle brute C3H6O2. Faux.
C3H6O3.
- Ces
deux structures sont images l'une de l'autre dans un miroir plan. Vrai.
- Ces deux structures sont des stéréoisomères de conformation.
Faux.
- Ces deux structures forment un couple
d'énantiomères. Vrai.
-Il est possible de passer d'une structure à l'autre par une rotation
autour d'une liaison simple. Faux.
2. Spectre RMN.
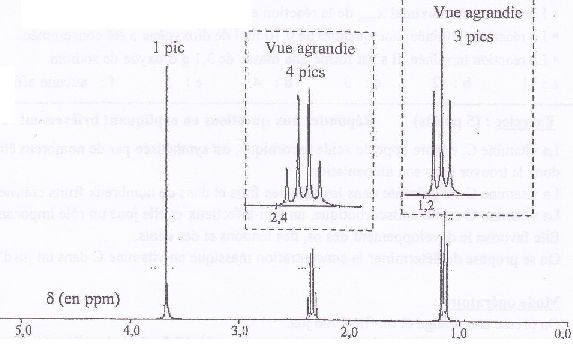
Masse molaire de la molécule M = 88 g/mol.
Parmi les molécules ci-dessous, indiquer celle qui correspond aux
données.
- Acide butanoïque. Faux.
M(C4H8O2)
=4*12+8+2*16= 88 g/mol.
Le spectre RMN indique la
présence de -CH2-CH3
et d'un proton sans
proche voisin.
Il ne peut pas s'agir d'un acide
carboxylique, le déplacement chimique du proton COOH se trouve vers 9,5 ppm.
- Acide 2-méthylpropanoïque. Faux.
(CH3)2CH-COOH.
M = 88 g/mol.
Le spectre RMN devrait
indiquer un doublet et un multiplet.
- Méthanoate de propyle. Faux.
HCOO-CH2-CH2-CH3.
M = 88 g/mol.
Il n'y a pas de proton
sans proche voisin.
- Butanone. Faux.
M(C4H8O)
= 4*12+8+16=72 g/mol.
- Propanoate de méthyle. Vrai.
H3C-CH2-COO-CH3.
|
| .
. |
|
|
3.
Précipité.
Dans un becher contenant V1
= 35,0 mL d'une solution de chlorure de calcium de concentration en
soluté apporté c1 = 290 mmol/L, on introduit un volume V2
= 20,0 mL d'une solution de phosphate de sodium de concentration en
soluté apporté c2 = 120 mmol/L. Le phosphate de calcium
précipite.
Cette réaction est supposée totale.
Calculer la masse de phosphate de calcium formé ( en mg).
372 ; 416 ; 567 ; 745 ; 835 ; aucune réponse exacte.
|
avancement
(mmol)
|
3Ca2+aq |
+ 2PO43-aq |
---> Ca3(PO4)2
(s) |
initial
|
0
|
V1c1=0,035*290
=10,15 mmol
|
V2c2=0,020*120
=2,4 mmol |
0
|
fin
|
x
|
10,15-3x
|
2,4
-2x
|
x
|
Si Ca2+aq est en
défaut : 10,15-3x=0 ; x = 3,38 mmol.
Si PO43-aq
est en défaut 2,4-2x=0 ; x = 1,2 mmol.On retient cette hypothèse.
Il se forme 1,2 mmol de phosphate de calcium.
M(Ca3(PO4)2) =3*40,1
+2*(31+4*16)=310,6 g/mol.
m = 1,2 *310,6 =372,7 ~373 mg.
4. Déterminer la concentration
finale des ions calcium ( en mmol/L).
0 ; 102 ; 119 ; 204 ; 312 ; aucune réponse exacte.
10,15 -3x = 10,15 -3*1,2 =6,55 mmol d'ion calcium dans 55 mL.
[Ca2+aq] =6,55 / 0,055 =119 mmol/L.
|
.
|
|
5. Combustion
du sodium dans le dioxygène.
Il se forme de
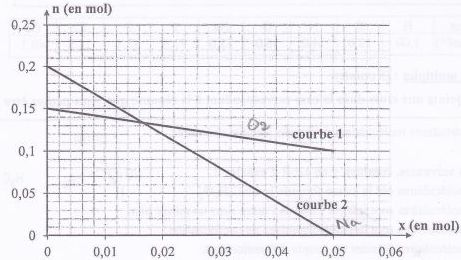
l'oxyde de sodium Na2O(s). Le graphe ci-dessous représente
l'évolution des quantités de matière des réactifs en fonction de
l'avancement x.
Parmi les affirmations suivantes combien y en a t-il d'exactes ? 3.
- La courbe 1 correspond à l'évolution de la quantité de dioxygène en
fonction de x. Vrai.
2Na(s) + ½O2(g)--->
Na2O (s).
La pente de la courbe 1
est 4 fois plus petite que celle de la courbe 2 ; ce qui
correspond aux nombres stoechiométriques.
- Le réactif limitant est le sodium. Vrai.
La quantité finale de
sodium est nulle.
- L'avancement maximal vaut 0,10 mol. Vrai.
0,20-2xmax
= 0.
- La réaction terminée, une quantité de 0,10 mol de dioxygène a été
consommée. Faux.
0,15-0,10 = 0,05 mol.
- Il se forme finalement 3,1 g d'oxyde de sodium. Faux.
Il se forme 0,10 mol de Na2O
soit :0,10 M(Na2O) = 0,10 *(2*23+16) =6,2 g.
|
|
|