Questions diverses
en chimie.
Concours assistant d'ingénieur Reims 2010
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
V.1. A quelles puissance de 10 correspondent les préfixes suivants :
milli : 10-3 ; pico : 10-12 ; nano : 10-9 ; micro : 10-6.
- Compléter les égalités suivantes :
1 nm = 10-3 µm ; 1 nm = 10 angström ; 1 L = 1000 mL ; 0,01 L = 10 cm3 ;
0,1 mL = 100 µL ; 1 dm3 = 1 L ; 1 m3 = 106 mL.
V.2. Sur l'étiquette d'une bouteille d'acide chlorhydrique commerciale on lit HCl 38 % en masse, densité d = 1,19.
- Quelle est la concentration molaire de HCl dans la solution ?
Masse d'acide HCl dans 1 L : m = 1190 *0,38 = 452,2 g.
Quantité de matière d'HCl : n = m / M = 452,2 / 36,5 ~12,4 mol dans 1 L.
- Quel volume d'acide commercial doit-on prélevé pour obtenir 1 L de solution molaire ?
1000 / 12,4 ~80,7 mL.
- Comment procéderiez-vous pour réaliser cette manipulation ?
Dans une fiole jaugée de 1 L contenant un tiers d'eau distillée ajouter
à la butrette graduée 80,7 mL de solution commerciale. Compléter avec
de l'eau distillée jusqu'au trait de jauge. Boucher et agiter pour
rendre homogène.
- On dilue 10 fois la solution précédente. Quel est le pH de la solution ?
Concentration c = 0,1 mol/L; cet acide est fort : pH = - log 0,1 = 1.
log K = (0,08+0,11) /
0,03 = 6,33 ; K =2,15 106.
V.3.
La consommation de votre laboratoire en acétone-d6 est de 35 mL par
semaine. Ce produit est vendu en flacon de 100 mL au prix de 22,6 €.
Vous êtes chargé de tenir et approvisionner ce produit en ayant 4 mois
d'avance. Sachant que vous n'avez plus de produit en stock, combien de
flacon devez-vous commander ? Quel sera le montant de la commande ?
4 mois = 52/3 = 17,3 soit 18 semaines
Volume d'acétone-d6 : 35*17,3 ~600 mL.
Prix de 6 flacons : 6*22,6 = 135,6 €.
V.4. Dans un catalogue de produits chimiques, on lit concernant le chloroforme -d ( d = 1,50).
Deux fournisseurs proposent ce omposé avec les mêmes caractéristiques aux conditionnements et tarifs suivants :
A : 100 g pour 40,2 € ; B : 100 mL pour 43,5 €.
Chez quel fournisseur passez-vous commande ?
Fournisseur B : masse de 100 mL : 150 g ; prix de 100 g : 43,5 /1,5 = 29 €.
V.5. On désire obtenir les résultats d'analyse élémentaire pour le composé ci-dessous :
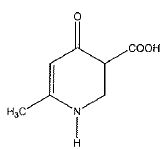 C7 H9NO3. C7 H9NO3.
C : 12,011 ; H : 1,0079 ; N : 14,0067 ; O : 15,9994 mol/L.
M = 7*12,011 +9*1,0079 +14,0067 +3*15,9994 =155,153 g/mol.
% carbone : 7*12,011 *100 / 155,153 = 54,19 %.
% H : 9*1,0079 / 155,153 *100 = 5,85 %.
% N : 14,0067 / 155,153 *100 = 9,03 %.
|
| .
. |
|
|
V.6. Parmi les couples de solvants suivants, indiquer celui ou ceux qui ne sont pas miscibles.
Eau / méthanol : miscibles.
eau / chloroforme : non miscibles.
eau / toluène : non miscibles.
eau / acétone : miscibles.
V.7. Suite à une synthèse, on obtient le composé A en solution dans l'eau.
CH3-CH2-CH2-CH(OH)-CH3.
On veut procéder à son extraction. Indiquer le ou les solvants que l'on pourra utiliser.
Le pentan-2-ol est peu soluble dans l'eau.
On doit choisir un solvant non miscible à l'eau, de densité différente
de celle de l'eau, dans lequel cet alcool soit très soluble : diéthylether oxyde.
- Où se trouve la phase organique ?
Le solvant le plus dense ( l'eau) occupe la partie inférieure, la phase organique se trouve au dessus de l'eau.
V.8. Pouquoi faut-il éviter de porter des bijoux en or lorsqu'on manipule du mercure ?
Le mercure forme un amalgame avec l'or.
|
|
|
|
V.9.
On désire purifier un composé par distillation sous pression réduite. Indiquer les éléments nécessaires.
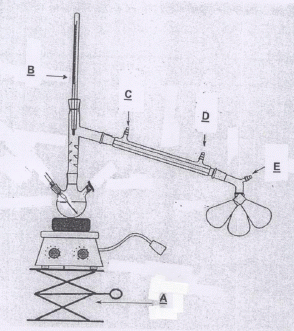
Montage de distillation fractionnée sous pression réduite.
A : élévateur à croisillons ; B : thermomètre ; C : sortie de l'eau ; D : entrée de l'eau ; E : vers la trompe à eau.
Séparateur multivoies ( pis) ; réfrigérant ; tuyau à vide ; chauffe-ballon ; pompe à vide.
V.10. Quelle relation existe-t-il entre les couples suivants ?
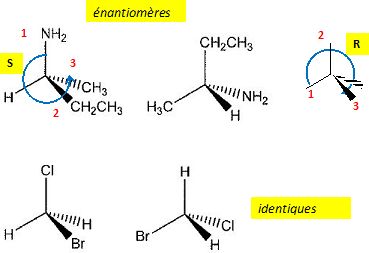
|
|
|
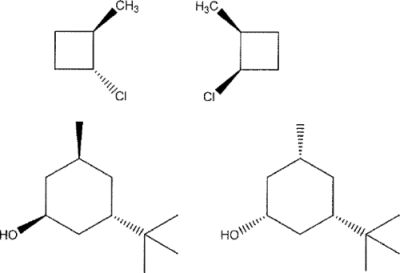
Les atomes de carbone asymétriques ne changent pas tous de configuration, donc diastéréoisomères.
|
|