Solution
d'ammoniac, conductimétrie.
Concours GEIPI 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
De nombreux produits
ménagers de nettoyage sont formulés à partir de solutions aqueuses
ammoniacales. L’ammoniac est un gaz de formule brute NH3.
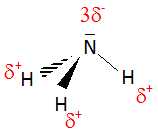
Ecrire le schéma de Lewis de la molécule d’ammoniac. La molécule
d’ammoniac est polaire. Le montrer en plaçant sur sa représentation
spatiale de Cram les charges partielles d-
et d+
.
Le composé NH3 est très soluble dans l’eau. Une
solution aqueuse d’ammoniaque est le siège
d’un équilibre entre NH3(aq) qui, par réaction
avec l’eau forme son acide conjugué : l’ion
ammonium NH4+. Le pKa
du couple
NH4+
/ NH3
vaut 9,2.
Rappeler l’expression littérale de la constante Ka
puis donner sa valeur numérique.
Ka = [NH3][H3O+]/[NH4+] = 10-9,2 =6,3 10-10.
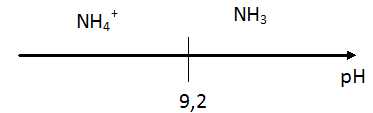
Etablir le diagramme de prédominance du couple
NH4+
/ NH3
sur une échelle de pH.
Ecrire sous forme d’équation-bilan l’équilibre acido-basique
né de la réaction entre NH3(aq) et l’eau.
NH3(aq)
+H2O(l) = NH4+ aq +HO-aq.
Une
solution ammoniacale S a été obtenue en dissolvant de l’ammoniac dans
V=200,0 mL d’eau
pure. Le pH initialement mesuré vaut pH = 10,94. Identifier
l’espèce prédominante dans la solution (hors solvant).
A pH
supérieur à pKa, la forme base NH3(aq)
prédomine.
On
se propose de réaliser le dosage de cette solution par un acide fort :
l’acide chlorhydrique
(H3O+ + Cl-).
On dispose à cet effet d’une solution d’acide chlorhydrique de
concentration :
CHCl = 0,30 mol/L. Le suivi de ce dosage est
effectué parallèlement par conductimétrie et pH-métrie. La réaction
acido-basique support du dosage est considérée comme totale :
NH3 + H3O+
→ NH4+ + H2O.
Les points expérimentaux obtenus en mesurant la conductivité en
fonction du volume d’acide
chlorhydrique versé s
= f(VHCl ) sont portés sur le graphique
ci-dessous.
|
| .
. |
|
|
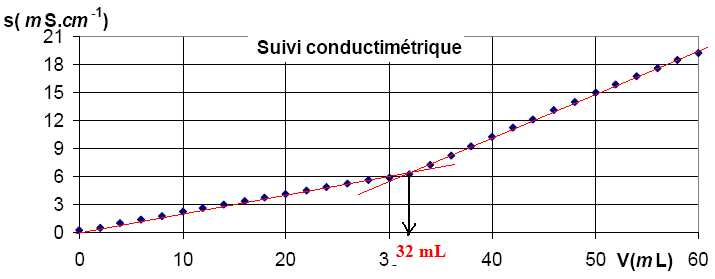
Déterminer le volume équivalent du titrage.
Calculer la concentration en ammoniaque CNH3 de
la solution S.
A
l'équivalence : CNH3 V =CHCl
Véq ; CNH3
=CHCl Véq / V = 0,30 *32 / 200 = 0,048 mol/L.
Compléter les 4 cases vides dans
l’extrait du tableau de suivi du dosage.
Données : Conductivités ioniques molaires en S.m2.mol-1.
l( H3O+) = 35,0.10-3
; l( NH4+) = 7,35.10-3
; l( HO -)
= 19,8.10-3 ; l( Cl -)
= 7,63.10-3.
|
.
|
|
| VHCl
(mL) |
[ H3O+] mol/L |
[ HO -
] mol/L |
[ NH4+]
mol/L |
[ Cl -
] mol/L |
s(mS cm-1) |
pH |
| 0 |
1,15
10-11 |
(1) |
8,64
10-4 |
0 |
0,23 |
10,94 |
| 16,0 |
6,78
10-10 |
1,47
10-5 |
2,30
10-2 |
2,22
10-2 |
3,39 |
(2) |
| 32,0 |
4,75
10-6 |
2,11
10-9 |
4,14
10-2 |
4,14
10-2 |
(3) |
5,32 |
| 50,0 |
2,14
10-2 |
4,68
10-13 |
3,84
10-2 |
(4) |
15 |
1,67 |
(1) : [ HO -
] = 10-14 / [ H3O+]= 10-14
/ (1,15
10-11)=8,70 10-4 mol/L.
(2) : pH = - log [ H3O+]= -log(6,78 10-10) =9,17.
(3) : s
= l( H3O+) [ H3O+] + l( NH4+) [ NH4+]
+l( HO -) [ HO -
] + l( Cl -) [ Cl -
]
s = 35,0.10-3
*4,75 10-3 + 7,35.10-3 *41,4
+ 19,8.10-3
*2,11 10-6 +7,63.10-3*41,4
=1,6625 10-4 + 0,30429 +1,51 10-7
+0,31588 = 0,620 S m-1 =6,20 mS cm-1.
(4) : la solution est électriquement neutre. [ H3O+] +[ NH4+]
=[ HO -
] +[ Cl -
]
[ Cl -
] = [ H3O+] +[ NH4+]
-[ HO -
] ~[ H3O+] +[ NH4+]
~ 2,14 10-2 + 3,84 10-2 = 5,98 10-2
mol/L.
|
|
|