QCM chimie,
questions 13 à 16. Concours Puissance 11.
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
13. Ester.
Lorsque
les fruits mûrissent, leurs membranes cellulaires s’oxydent ; il en
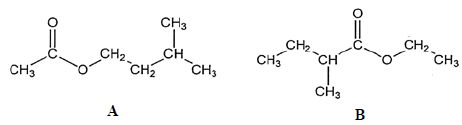
résulte la formation de deux molécules A et B représentées ci-dessous :
Au laboratoire, on réalise dans un ballon la synthèse du composé A en
chauffant à reflux, pendant 30 minutes, 11 mL de 3-méthylbutan-1-ol,
30mL d’acide éthanoïque pur et 1mL d’acide sulfurique concentré en
présence de quelques grains de pierre ponce. Après traitement du
ballon, on récupère 13 mL de la molécule A. Cette réaction est appelée
réaction d’estérification. L’équation associée à cette transformation
s’écrit :
CH3-COOH + (CH3)2CH-CH2-CH2-OH = CH3-COO-CH2-CH2-CH(CH3)2 + H2O.
Données : Densités par rapport à l'eau à 20 °C et masses molaires en g.mol-1 :
Densité
|
Molécule A
0,87
|
3-méthylbutan-1-ol
0,80
|
Acide éthanoïque
1,05
|
Masse molaire (g/mol)
|
130
|
88
|
60
|
Masse volumique de l'eau : reau = 1,0 g.mL1.
a) A et B sont isomères. Vrai.
Ils ont la même formule brute C7H14O2, mais des formules semi-développées différentes.
b) A s’appelle le 3-méthylbutanoate d’éthyle. Faux.
Ethanoate de 3-méthylbutyle.
c) Le rendement de la réaction est égal à 87%. Vrai.
Quantités de matière des réactifs : n(alcool) = 11*0,80 / 88 =0,10 mol ;
n(acide) = 30*1,05 / 60 =0,525 mol ( en excès).
On peut espérer au mieux obtenir 0,10 mol d'ester.
Quantité de matière réelle d'ester : 13*0,87 / 130 = 0,087 mol.
Rendement 0,087 /0,1 = 0,87 ( 87 %).
Le composé B présente deux stéréoisomères B1 et B2 dessinées ci-dessous :
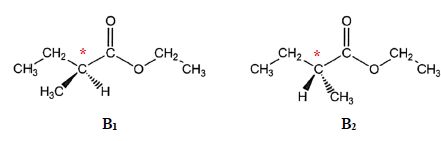
d) B1 et B2 sont des diastéréoisomères. Faux.
B1 et B2 sont des énantiomères.
14. Méthacrylate de méthyle.
Le
méthacrylate de méthyle, noté MAM, est une espèce chimique utilisée
pour produire un polymère thermoplastique transparent, le
polyméthacrylate de méthyle, plus connu sous son nom commercial : le
plexiglass. Un des procédés de fabrication appelé le misubishi gas
chemicals ou MGC consiste en une synthèse dont l’équation est modélisée
ci-dessous par :
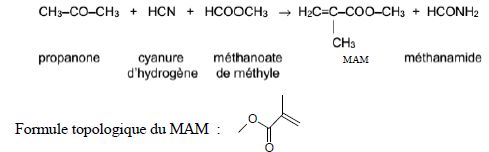
Masse molaire ( g / mol) :Propanone : 58 ; cyanure d’hydrogène : 27 ; méthanoate de méthyle : 60 ; MAM : 100.
a) Le MAM ne possède pas de stéréoisomères de conformation. Vrai.
Pas de rotation possible autour d'une double liaison.
b) Le MAM possède une isomérie Z/E. Faux.
c) La propanone donne deux signaux en spectroscopie RMN. Faux.
Un seul signal correspondant aux 6 protons équivalents.
d) Le mélange de 580 kg de propanone, 270 kg de cyanure d’hydrogène et
de 600 kg de méthanoate de méthyle permet de produire une tonne de MAM.
Vrai.
Quantité de matière : propanone : 580 /0,058 =104 mol ;
cyanure d'hydrogène : 270/0,027 = 104 mol ;
méthanoate de méthyle : 600 / 60 = 104 mol ;
on peut obtenir 104 mol de MAM soit une tonne.
|
| .
. |
|
|
15. Nitrile.
Les
gants en nitrile permettent de diminuer les risques d’allergies
provoquées par les gants en latex. Les nitriles, de formule générale CnH2n-1N, peuvent être obtenus par réaction entre un ion cyanure CN- et un halogénoalcane.
Cette réaction peut être modélisée par l’équation suivante :
CN- + C3H7Br (molécule A) ---> C4H7N + Br- (réaction n°1)
Données : L’électronégativité du brome est supérieure à celle du carbone.
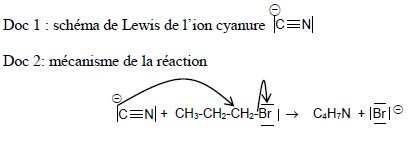
a) L’ion cyanure possède un site donneur et un site accepteur d’électron. Faux.
b) Le carbone lié au brome, dans l’halogénoalcane (molécule A), est un site accepteur d’électrons. Vrai.
c) Une flèche courbe correspond au déplacement d’un doublet d’électron. Vrai.
d) La réaction n°1 est une réaction d’élimination. Faux.
Réaction de substitution.
|
.
|
|
16. Hydrolyse basique d'un ester.
On envisage trois mécanismes réactionnels pour la réaction d’hydrolyse basique d’un ester.
L’équation modélisant la transformation s’écrit : RCOOR’ + HO- ---> RCOO- + R’OH.
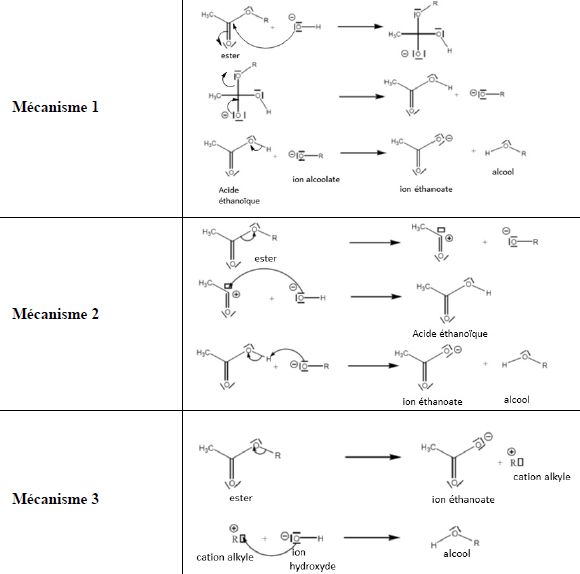
a) Les ions hydroxyde HO- sont des sites donneurs d’électrons. Vrai.
b) Lors d’une hydrolyse basique, les ions hydroxyde jouent un rôle de catalyseur. Faux.
Ils ne sont pas régénérés dans la dernière étape du mécanisme.
c) Dans la dernière étape du mécanisme 1, une flèche courbe (non
représentée) devrait partir du doublet de l’oxygène de l’ion alcoolate
vers le carbone du groupement carboxyle porté par l’acide éthanoïque.
Faux.
Une flèche courbe devrait partir du doublet de l’oxygène de l’ion alcoolate vers l'atome d'hydrogène acide. Réaction acide base, échange de proton.
Pour valider les
hypothèses concernant les mécanismes, une technique consiste à
remplacer, dans un des réactifs, un atome ou un groupe d’atomes par des
isotopes de manière à pouvoir les utiliser comme « traceurs ». A la fin
de la transformation, la position des traceurs dans une chaîne carbonée
est repérée grâce à des techniques de spectroscopie comme, par exemple,
la résonance magnétique nucléaire (RMN). On utilise souvent en chimie
organique un isotope rare de l’oxygène, l’oxygène 18 (au lieu de
l’isotope le
plus abondant 16O).
Dans l’exemple de l’hydrolyse basique, on effectue la réaction avec l’ion hydroxyde HO-, dans lequel l’oxygène est l’isotope 18O. On constate expérimentalement que cet oxygène « lourd » se retrouve uniquement dans l'anion éthanoate.
d) Seul le mécanisme 1 correspond aux constatations expérimentales concernant le traceur. Faux.
|
|