QCM chimie,
questions 7 à 12. Concours Puissance 11.
2015
|
|
|
|
|
|
|
7. Le vinaigre.
Les vinaigres sont des solutions aqueuses contenant de l’acide
éthanoïque, de formule CH3COOH. Le degré ou le pourcentage
indiqué sur les bouteilles de vinaigre correspond à la masse d’acide
éthanoïque, exprimée en gramme, contenue dans 100 g de vinaigre.
On titre, par conductimétrie, un volume de 100 mL d’une solution
contenant 5,0 g de vinaigre pur, par une solution d’hydroxyde de sodium
(Na+(aq) + HO-(aq)) de concentration C = 4,0.10-1
mol.L-1.
La réaction de titrage est la suivante :
CH3COOH(aq) + HO-(aq) ---> CH3COO–(aq)
+ H2O(l).
La courbe du titrage donnant l’évolution de la conductivité en fonction
du volume d’hydroxyde de sodium introduit est représentée ci-dessous :
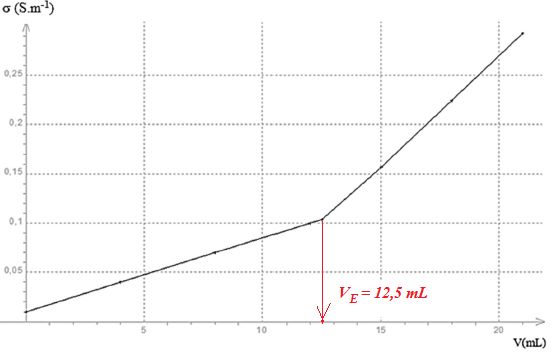
a) L’augmentation de la conductivité de la solution avant l’équivalence
est principalement due à
l’augmentation de la concentration en ions hydroxyde dans la solution.
Faux.
Avant l'équivalence, (
ion hydroxyde en défaut ) l'augmentation de la conductivité est due à
l'ajout d'ion sodium et à l'apparition d'ion éthanoate.
Après l'équivalence, (ion
hydroxyde en excès) l'augmentation de la conductivité est due à l'ajout
d'ion sodium et d'ion hydroxyde de conductivité molaire ionique très
grande.
b) La courbe de titrage montre que la conductivité molaire ionique des
ions hydroxyde est
supérieure à celle des ions éthanoate. Vrai.
c) La quantité de matière d’acide éthanoïque dans la solution titrée
est égale à 5,0 mmol. Vrai.
Quantité de matière
d'acide éthanoïque : CVE =0,40 *12,5 = 5,0 mmol.
d) Le degré du vinaigre titré est égal à 8,0. Faux.
Masse d'acide éthanoïque
dans 5,0 g de vinaigre :
CVE
*M(acide éthanoïque) =5,0
10-3 *60 =0,3 g ;
soit dans 100 g de
vinaigre : 0,3 *20 =6,0 g ou 6 degrés.
8. L'aspirine.
L’aspirine est un médicament
permettant de lutter contre la fièvre, la douleur et favorisant la
fluidité du sang. Il existe sous deux formes, la forme acide appelé
acide acétylsalicylique de formule C9H8O4
et la forme basique appelé ion acétylsalicylate.
La solubilité de l’aspirine n’est pas très élevée dans l’eau : il est
plus facile d’avaler un comprimé non effervescent avec de l’eau que
d’essayer de le dissoudre car on obtient une solution saturée.
Données : Constante d’acidité du couple acide acétylsalicylique/ion
acétylsalicylate : Ka = 10-4,2 ;
Masse molaire de l’aspirine : M = 180 g.mol-1 ; masse
volumique de l’eau : r = 1,0
g.mL-1 ;
Aide au calcul : 180 x 0,018 ≈ 3,3 ;
Masse d’eau froide ou chaude permettant de dissoudre complétement 1,0 g
d’aspirine :
eau à 25°C : 300 g ; eau à 100°C : 14 g.
a) La solubilité de l’aspirine dans l’eau diminue lorsque la
température augmente. Faux.
b) La concentration molaire maximale en acide acétylsalicylique d’une
solution obtenue en dissolvant 1,0 g d’aspirine dans de l’eau à 25°C
est environ égale à 1,8 mmol.L-1. Faux.
n(aspirine) =1,0 / 180
mol ; puis 1,0 /(180*0,3)=0,0185 mol/L ~18 mmol/L.
Durant la digestion, le pH de l’estomac est voisin de 1,5.
c) C’est la forme acide de l’aspirine qui est prédominante au sein de
l’estomac. Vrai.
A pH inférieur au pKa, la forme acide prédomine.
La forme acide de l’aspirine est soluble dans les lipides comme ceux
constituant la barrière lipidique des cellules de l’estomac. Le pH à
l’intérieur de ces cellules vaut 7,2.
d) La concentration de la forme basique est 1000 fois supérieure à
celle de la forme acide à l’intérieur des cellules. Vrai.
pH = pKa
+ log([A-] / [AH]) ; log([A-] / [AH]) =
7,2-4,2 = 3 ; [A-] / [AH] = 1000.
9. Spectroscopie.
On fait réagir un bromoalcane de formule C3H7Br
avec de l’hydroxyde de sodium (Na+ + HO-) en
solution alcoolique. En fin de réaction, l’analyse d’un échantillon du
mélange réactionnel permet par un test aux ions argent d’identifier la
présence d’ions bromure. L’analyse spectroscopique IR et RMN de
l’échantillon donnent les résultats ci-dessous :
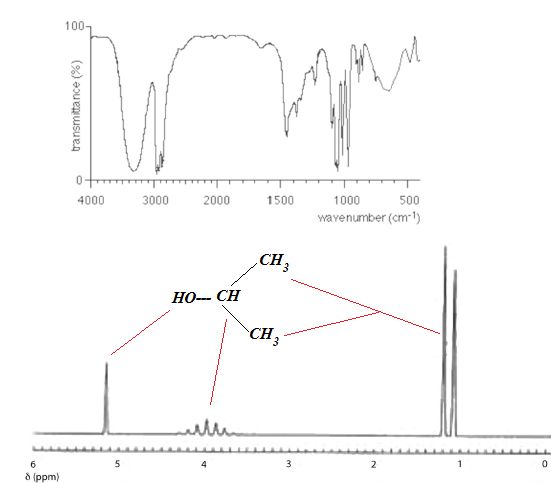
a) Le produit de la réaction est une cétone. Faux.
Absence du pic
caractéristique du carbonyle vers 1700 cm-1
sur le specre IR.
b) La molécule possède trois groupes de protons équivalents. Vrai.
c) Le multiplet qui sort à 4 ppm est un quintuplet. Faux.
Heptuplet. ( un proton couplé avec 6 protons voisins
équivalents).
d) Le bromoalcane qui réagit avec l’hydroxyde de sodium est le
1-bromopropane. Faux.
Le 2-bromopropane.
|
| .
. |
|
|
10.
Menthol et menthone.
Le menthol est un composé organique obtenu soit par synthèse, soit par
extraction à partir de l'huile
essentielle de menthe poivrée ou d'autres huiles essentielles de
menthe. Ces huiles essentielles contiennent également de la menthone,
qui peut être synthétisée par oxydation du menthol.
On donne ci-dessous les représentations topologiques de l’un des 8
stéréoisomères du menthol et de l’un des quatre stéréoisomères de la
menthone.
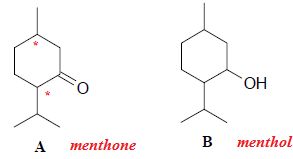
a) La molécule A est le menthol. Faux.
L'oxydation ménagée d'un
alcool secondaire donne une cétone.
b) Les molécules A et B sont des stéréoisomères de conformation. Faux.
L'une possède une
fonction alcool, l'autre une fonction cétone.
c) La molécule A comporte 3 carbones asymétriques. Faux.
Les deux spectres infrarouges ci-dessous sont pour l’un celui d’un des
stéréoisomères du menthol, pour l’autre celui d’un des stéréoisomères
de la menthone.
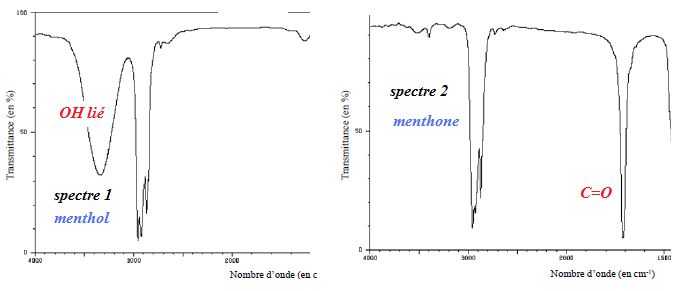
d) Le spectre 1 correspond à la molécule B. Vrai.
|
.
|