QCM chimie,
questions 1 à 6. Concours Puissance 11.
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
1. L'acide
lactique.
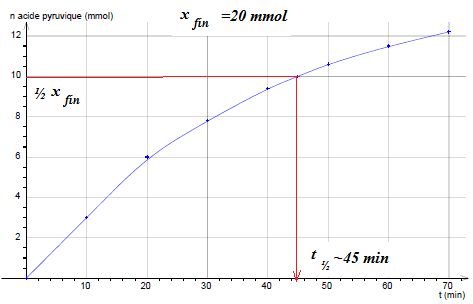
On
étudie l'évolution au cours du temps d'un mélange de 20 mmol d'acide
lactique et d'une solution de permanganate de potassium acidifiée, les
ions permanganate sont en excès. L'évolution de la quantité de matière
d'acide pyruvique formée en fonction du temps est représentée
ci-dessous.
a) Le nom systématique de l'acide pyruvique est acide
2-hydroxybutanoïque. Faux.
 acide 2-oxopropanoïque acide 2-oxopropanoïque
b) Il existe deux
énantiomères de l'acide lactique. Vrai.
L' atome de carbone n°2
est asymétrique.
c) La masse molaire de l'acide pyruvique est 92 g/mol. Faux.
M(C3H4O3)=
12*3+4+3*16=88 g/mol.
d) Le temps de demi-réaction est égal à t½=35
min. Faux.
2.
Zinc en milieu acide.
Le zinc est un métal qui réagit
totalement en milieu acide, selon :
Zn(s) + 2H3O+aq ---> Zn2+aq + H2(g)
+ 2H2O(l).
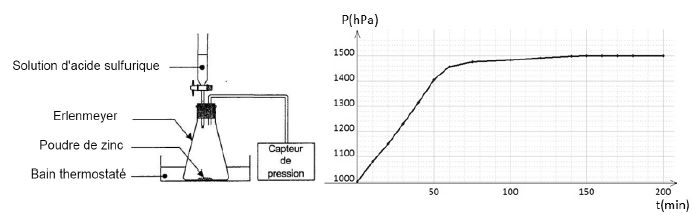
On verse V=50 mL d'acide fort de concentration c= 2,0 mol/L dans un
erlenmeyer contenant 5,2 g de zinc en poudre. M(Zn) = 65,4 g/mol. On
mesure l'évolution de la pression P au cours du temps. On note DP = P-P0, P0
étant la pression à la date t=0.
On donne q = 27°C
; R = 8,31 S.I ; 5,2 = 65,4 *0,08.
a) La variation de pression dans l'erlenmeyer est proportionnelle
à la quantité de matière de dihydrogène formé. Vrai.
b) La quantité de dihydrogène formé est égale à la quantité de zinc
introduite. Vrai.
L'acide sulfurique est un
diacide : n(H3O+) =V 2 c=0,050 *2*2 =0,2 mol ;
0,2 mol d'ion oxonium peut réagir avec 0,1 mol de zinc. ( l'acide
sulfurique est en excès).
n(Zn)=n(H2) = 5,2
/ 65,4 =0,08 mol.
c) Le volume de gaz dégagé
dans l'enceinte est égal à 2,5 L. Faux.
Pression finale P = 1500
hPa ; DP = 500 hPa = 5,0 104
Pa.
V = nRT / DP =0,08 *8,31 *(273+27) / (500 *100)=0,004 m3 = 4 L.
d)
A la fin de la transformation il reste au fond de l'erlenmeyer moins de
la moitié de la quantité de matière initiale de zinc. Faux.
Le zinc est en défaut
3. iodure de
méthyle et hydroxyde de sodium en excès.
CH3I + HO-aq ---> CH3OH + I-aq.
La concentration molaire initiale de l'iodure de méthyle est notée c0.
L'évolution de la concentration de la solution d'iodure de méthyle peut
se mettre sous la forme
c = a / (1+bt), a et b sont des constantes.
a) A t = 0, la valeur de a est égale à c0. Vrai.
b) A la fin de la réaction, il ne reste plus d'iodure de méthyle dans
le milieu réactionnel. Vrai.
t tend vers l'infini, 1 / (1+bt) tend vers zéro.
c)
Le temps de demi-réaction est égal à t½=b. Faux.
c(t½)=½c0
= c0 /(1+bt½) ; 1+bt½ = 2 ; t½ = 1/b.
d) La concentration c' du méthanol peut s'écrire c'
= c0 b t / (1+bt). Vrai.
c' = c0-c = c0[1-1
/(1+bt) ]= c0 bt / (1+bt).
4.
Dosage de sions nitrite NO2-aq.
Les
ions nitrite sont incolores en solution aqueuse. Pour les doser, on se
propose, après prélevement d'un échantillon de 1 mL de solution,
d'ajouter 1 mL de réactif de Griess. On obtient une solution aqueuse
colorée rouge qui permet d'effectuer un dosage colorimétrique par
spectrophotométrie. Le spectrophotomètre est réglé sur l = 520 nm.
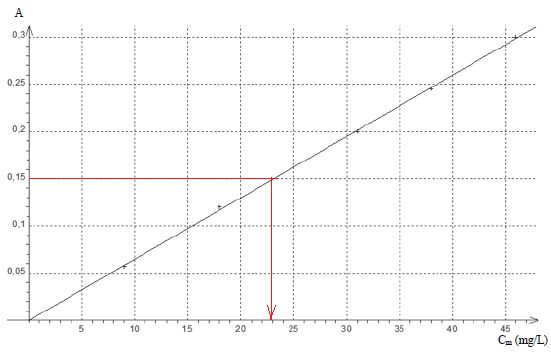
On réalise cette opération pour doser les nitrites dans un aquarium et
on mesure une absorbance A = 0,15. Des solutions étalons, préparées
dans les mêmes conditions, ont permis d'obtenir la droite d'étalonnage
A = f(Cm) représentée ci-dessous où Cm est la concentration
massique en ion nitrite dans l'échantillon prélevé.
a) La longueur d'onde choisie doit
correspondre à un maximum d'absorption de la solution. Vrai.
b) La
radiation à 520 nm correspond à une radiation rouge.
Faux.
La radiation à 520 nm
correspond au bleu-vert, couleur complémentaire du rouge.
c)
La concentration massique en ion nitrite est égale à environ 23 mg/L. Vrai.
d) La
concentration molaire en ion nitrite dans l'aquarium est égale à
environ 0,50 mmol/L.Vrai.
M(NO2-) = 14+2*16 = 46 g/mol puis 23 /46 =0,50
mmol/L
|
| .
. |
|
|
5.
Dosage de la polyvidone.
La polyvidone iodée est un complexe formé par l'association d'une
molécule de polyvidone et d'une molécule de diiode. On souhaite
vérifier l'indication " polyvidone iodée : 9,5 g pour 100 mL"
figurant sur l'étiquette d'un antiseptique. Pour cela on dilue 10 fois
la solution commerciale. On prélève 10 mL de solution diluée que l'on
titre avec une solution de thiosulfate de sodium de concentration c =
5,0 10-3 mol/L en présence d'un indicateur coloré, le
thiodène. L'équivalence est obtenue pour VE=16,0 mL de
thiosulfate de sodium versé.
L'équation de la réaction du titrage est : I2 aq + 2S2O32-aq
---> 2I-aq + S4O62-aq.
Masse molaire du polyvidone iodé M = 2363 g/mol
a) Le prélevement, pour
effectuer la dilution, se fait avec une éprouvette graduée. Faux.
Pipette jaugée et fiole
jaugée.
b) A l'équivalence, la quantité de matière de thiosulfate de sodium
versée est égale à celle du diiode initiale. Faux.
n(S2O32-) = 2 n( I2).
c) La concentration en diiode
dans la solution commerciale est égale à 4,0 mmol/L. Faux.
n( I2)= ½n(S2O32-) =0,5 C VE =0,5 *5,0
10-3 *16,0 = 0,040 mmol dans 10 mL ;
soit 0,040 / 10 = 0,004 mol/L = 4,0 mmol/L.
Puis tenir compte de la dilution au dixième : 40 mmol/L.
d) L'information concernant le
polyvidone iodée est exacte. Vrai.
40 *2363 = 9,45 104
mg/L ~ 95 g/L ou 9,5 g dans 100 mL
|
.
|
|
6. Titrage
acide faible base forte.
Une solution aqueuse d'un acide faible, noté AH, est dosée par une
solution d'hydroxyde de sodium de concentration massique en soluté
apportée Cm =8,00 g/L. L'évolution du pH en fonction du
volume versé VB est donné ci-dessous. M(NaOH) = 40 g/mol.
L'équation associée à cette transformation est AH +HO---->
A- +H2O.
a) La concentration molaire en ion hydroxyde est égale à 0,200 mol/L.
Vrai.
8,00 / 40,0 =0,200
mol/L.
b) Le volume à l'équivalence est VE = 14,5 mL. Vrai.
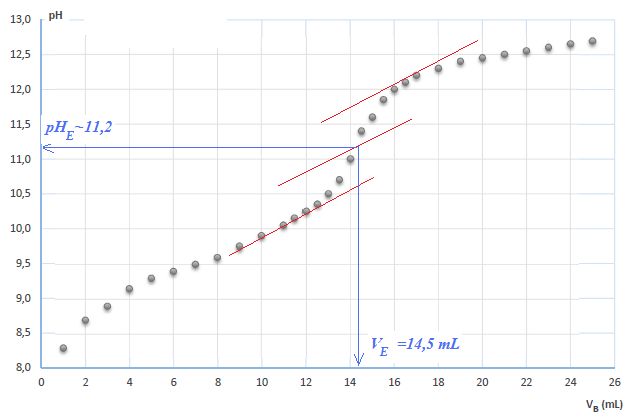
c) L'indicateur à utiliser est la phénolphtaléine. Faux.
La zone de virage de
l'indicateur doit contenir le pH du point équivalent. L'alizarine convient.
d) A l'équivalence, l'une des espèces majoriatires est la base A-.
Vrai.
|
|