Synthèse
de l'aspirine : concours
Technicien Sorbonne 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Structure de l'aspirine :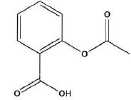
Que signifie les termes antalgique et antipyrétique ?
Antalgique : propre à calmer la douleur ; antipyrétique : traitement de la fièvre.
Parmi les propositions suivantes, laquelle ( lesquelles) est ( sont) exacte(s) concernant l'aspirine ?
Son autre nom est l'acide acéthylsalicylique. Vrai.
Son autre nom est l'anhydride acéthylsalicylique. Faux.
Sa nomenclature selon les règles de l'UPAC est acide acéthyloxybenzoïque. Faux.
Sa nomenclature selon les règles de l'UPAC est acide 2-acéthyloxybenzoïque. Vrai.
Sa formule brute est C9H7O4. Faux. (C9H8O4)
L'aspirine est une molécule chirale. Faux.
Son carbone asymétrique est de cnfiguration R. Faux.
L'aspirine est corrosif. Faux.
The synthesize aspirine, a common analgesic drug, the first step
involves the reaction of salicyc acid and acetic anhydride in the
presence of a catalyst, phosphoric acid. Once the aspirin is prepared
it must be isolated from the reaction solution and purified. The
aspirin is insoluble in cold water, and can be isolated by filtering
the chilled reaction solution. Purification is necessary to remove any
unreacted salicylic acid and acetic anhydride, as well as the acetic
acid product and phosporic acid. Acetic anhydride is caused to
decompose by the addition of water once the formation of aspirine is
complete. Te impur aspirin is dissolved in warm ethanol and then cooled
slowly. The aspirin cristallize our of solution leaving the salicylic
acid and ather impurities behind.
Traduire ce texte.
La
première étape de la préparation de l'aspirine
, un analgésique commun, consiste à faire agir de l'acide salicylique
et de l'anhydride acétique
en présence d'un catalyseur, l'acide phosphorique. Une fois préparée,
l'aspirine est isolée du milieu réactionnel et purifiée. L'aspirine est
insoluble dans l'eau froide et peut être isolée par
filtration à froid. La purification est nécessaire pour éliminer tout
l'acide n'ayant pas réagi , l'acide phosphorique ainsi que l'anhydride
acétique et parmi les produits, l'acide acétique. L'anhydride en excès
est décomposé par addition d'eau.
L'aspirine impure est dissoute dans l'éthanol à chaud puis refroidie
lentement. L'aspirine cristallise séparée de l'acide salicylique et des
autres impuretés.
Identifier l'anhydride acétique parmi les composés suivants.
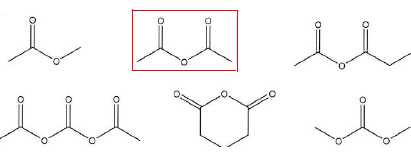 Le solide à purifier est dissout dans un solvant ou
dans un mélange de plusieurs solvants chaud ; puis on refroidit la
solution pour provoquer la cristallisation du solide que l’on isole par
filtration. Quant aux impuretés, elles doivent êtres solubles dans le
solvant à chaud comme à froid.
Citer le matériel nécessaire pour une recristallisation.
Dispositif de chauffage à refflux, dispositif de filtration simple, bain de glace-eau pour accélérer la cristallisation.
Comment peut-on vérifier l’efficacité d’une recristallisation ?
Mesure du point de fusion du solide sur un banc Kofler ou chromatographie CCM.
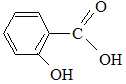
L'acide salicylique a pour nom IUPAC acide ortho-hydroxybenzoïque. proposer une structure de celui-ci. Le solide à purifier est dissout dans un solvant ou
dans un mélange de plusieurs solvants chaud ; puis on refroidit la
solution pour provoquer la cristallisation du solide que l’on isole par
filtration. Quant aux impuretés, elles doivent êtres solubles dans le
solvant à chaud comme à froid.
Citer le matériel nécessaire pour une recristallisation.
Dispositif de chauffage à refflux, dispositif de filtration simple, bain de glace-eau pour accélérer la cristallisation.
Comment peut-on vérifier l’efficacité d’une recristallisation ?
Mesure du point de fusion du solide sur un banc Kofler ou chromatographie CCM.
L'acide salicylique a pour nom IUPAC acide ortho-hydroxybenzoïque. proposer une structure de celui-ci.
Proposer une équation bilan de la réaction entre l'acide salicylique et l'anhydride acétique pour donner l'aspirine.Le solide à purifier est dissout dans un solvant ou
dans un mélange de plusieurs solvants chaud ; puis on refroidit la
solution pour provoquer la cristallisation du solide que l’on isole par
filtration. Quant aux impuretés, elles doivent êtres solubles dans le
solvant à chaud comme à froid.
Citer le matériel nécessaire pour une recristallisation.
Dispositif de chauffage à refflux, dispositif de filtration simple, bain de glace-eau pour accélérer la cristallisation.
Comment peut-on vérifier l’efficacité d’une recristallisation ?
Mesure du point de fusion du solide sur un banc Kofler ou chromatographie CCM.
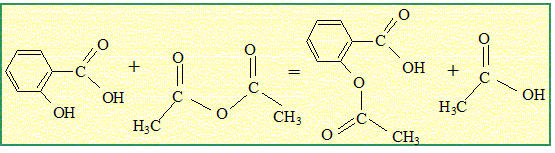 Le produit secondaire de la réaction est l'acide éthanoïque. Le produit secondaire de la réaction est l'acide éthanoïque.
|
| .
. |
|
|
Donner la définition d'un catalyseur.
Un
catalyseur accélère une réaction lente, thermodynamiquement possible.
Il est régénéré au cours de la dernière étape et n'apparaît pas dans le
bilan.
Proposer une formule brute pour le catalyseur de cette réaction.
H3PO4.
Quels sont les composés éliminés lors de l'étape de purification ?
Acide éthanoïque, acide salicylique, autres impuretés.
Comment s'appelle la dernière étape ?
Recristallisation.
Traduire la phrase " the aspirin is insoluble in cold water" et proposer une explication.
L'aspirine
est insoluble dans l'eau froide. De par sa structure ( noyau
benzénique, chaîne carbonée ), l'asprine a peu d'affinité pour un
solvant polaire comme l'eau.
Proposer une liste de matériel pour cette expérience.
Chauffage à reflux.
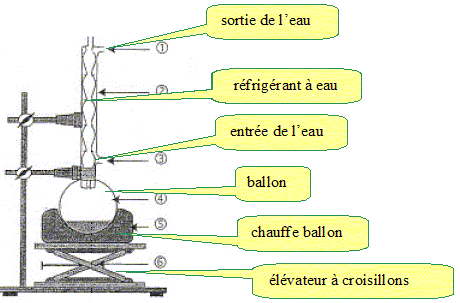
Recristallisation.
Le solide à purifier est dissout dans un solvant ou
dans un mélange de plusieurs solvants chaud ; puis on refroidit la
solution pour provoquer la cristallisation du solide que l’on isole par
filtration. Quant aux impuretés, elles doivent êtres solubles dans le
solvant à chaud comme à froid.
Citer le matériel nécessaire pour une recristallisation.
Dispositif de chauffage à refflux, dispositif de filtration simple, bain de glace-eau pour accélérer la cristallisation.
Comment peut-on vérifier l’efficacité d’une recristallisation ?
Mesure du point de fusion du solide sur un banc Kofler ou chromatographie CCM.
|
.
|
|
Pour évaluer la pureté d'un produit, plusieurs techniques sont envisageables.
Cocher la ( les) case(s) correspondantes au type d'échantillon susceptible et judicieux d'être analysé suivant chaque technique.
| Technique | Solide ( poudre) | Liquide ( huile) | Solide ou liquide en solution | | RMN |
|
| Dissoudre le solide dans un solvant deutéré CDCl3.
| | Réfractométrie |
|
| X
| | Spectroscopie IR | X
| liquide placé entre
deux plaques de sels très pur
|
| | Polarimétrie |
|
| Solution contenant une ou plusieurs molécules chirales.
| | Spectroscopie UV visible |
|
| X
| | Diffraction des rayons X | structure cristalline
|
|
| | Banc Kofler | mesure point de fusion
|
|
| | Chromatographie en phase gazeuse |
|
| Vaporisation du mélange à analyser à l'entrée de la colonne.
| | Chromatographie sur couche mince |
|
| X
|
Relier chacune des techniques avec les lois ou phénomènes physiques mis en jeu. On explicitera les réponses sous la forme Lettre-Nombre ( exemple : J-0).
| Techniques | Loi ou phénomène mis en jeu. | | A | RMN | 1 | Loi de Bragg | | B | Réfractométrie | 2 | Lois de Snell-Descartes | | C | Spectroscopie IR | 3 | Relaxation des spins nucléaires | | D | Polarimétrie | 4 | Déviation du plan de polarisation | | E | Spectroscopie UV-visible | 5 | Vibration des liaisons des molécules | | F | Diffraction des rayons X | 6 | Loi de beer-Lambert | | G | Banc Kofler | 7 | Phénomène de capillarité et d'absorption. | | H | Chromatographie en phase gazeuse | 8 | Transition de phase | | I | Chromatographie sur couche mince | 9 | Transition de phase et adsorption |
A-3 ; B-2 ; C-5 ; D-4 ; E-6 ; F-1 ; G-8 ; H-9 ; I-7.
|
|
|