Chimie
générale : concours
Technicien Sorbonne 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Compléter
le tableau.
Nom
de l'atome
|
Symbole
|
Nom
de l'atome
|
Symbole
|
Bore
|
B
|
Brome
|
Br
|
Azote
|
N
|
Or
|
Au
|
Nickel
|
Ni
|
Sodium
|
Na
|
| Potassium |
K |
Magnésium |
Mg |
Donner
la composition en protons, neutrons, électrons.
|
Protons |
Neutrons |
Electrons |
| 3517Cl |
17 |
35-17=18 |
17 |
| 3517Cl- |
17 |
35-17 =
18 |
17+1 =18 |
| 3919K+ |
19 |
39-19=20 |
19-1=18 |
Parmi les
configurations électroniques suivantes, indiquer celles qui sont
correctes.
Li : K2L1 vrai. Oxygène O
: K2L6 vrai. Azote :
K2L7 faux. (
K2L5). Soufre :
K2L8 M6
vrai.
Quelles
sont les formes géométriques des molécules ?
NH3 : pyramide à base triangulaire ; CH4
: tétraèdre ; H2S : coudée ; PO43-
: tétraèdre.
Entourer
la structure de Lewis correcte pour l'atome de chlore et pour la
molécule d'eau.
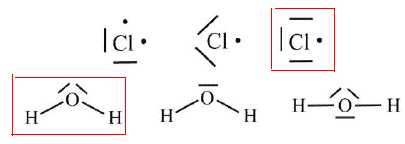
Donner le
schéma deLewis des composés suivants.
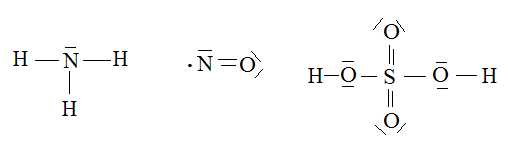
Indiquer
le nom de la famille des éléments appartenant aux colonnes suivantes du
tableau périodique.
Colonne 1 : alcalins ; colonne 2 : alcalin-terreux ; colonnes
16 : chalcogènes ; colonne 17 : halogènes ; 18 : gaz nobles.
Parmi
les affirmations suivantes, indiquer celles qui sont correctes.
L'électronégativité selon Pauling est la tendance d'un élément engagé
dans une combinaison chimique à attirer des électrons vers lui. Vrai.
L'oxygène est plus électronégatif que le soufre. Vrai.
L'oxygène est moins électronégatif que le phosphore. Faux.
L'oxygène est moins électronégatif que
le lithium. Faux.
Le rayon atomique des éléments augmente de la gauche vers la droite sur
une même période. Vrai.
Le rayon atomique des éléments augmente du haut vers le bas dans une
même colonne. Vrai.
Le vanadium et l'argent appartiennent au même bloc. Faux.
|
| .
. |
|
|
A quel
édifice cristallin appartiennent les composés suivants.
Si : covalent type diamant ; Na : métallique ; H2O
: moléculaire ; NaCl : ionique ; Cu : métallique.
A
quelle classe de matériaux appartiennent les matériaux suivant
?
Nylon : polymères ; Alumine : matériau réfractaire, céramique ; béton armé : composites ;
acier : métaux et alliages.
Donner
les équations chimiques qui correspondent aux réactions suivantes.
- le chlorure d'aluminium est produit industriellement par la réaction
directe des corps simples aluminium et chlore.
2Al + 3Cl2 ---> 2AlCl3.
- lors de la combustion du méthane il se forme du dioxyde de carbone et
de l'eau.
CH4 + 2O2 ---> CO2
+ 2H2O.
- lors de la thermolyse du carbonate de calcium, il se forme
de l'oxyde de calcium et du dioxyde de carbone.
CaCO3 ---> CaO + CO
- lors de l'hydrolyse de l'oxyde de baryum il se forme de l'hydroxyde
de baryum.
BaO + H2O ---> Ba(OH)2.
|
.
|
|
Acide base.
Classer par ordre de pH croissant les solutions aqueuses décimolaires
suivantes.
acide chlorhydrique < acide éthanoïque < ammoniaque.
On donne les valeurs des pKa des acides suivants
: acétique : 4,7 ; fluorhydrique : 3,2 ; méthanoïque : 3,75 ; chloreux
: 1,9
Indiquer
la formule de ces différents acides.
Acide acétique CH3-COOH ; acide fluorhydrique HF
; acide méthanoïque : HCOOH ; acide chloreux HClO2.
Pour une même concentration initiale en acide X, classer
les 4 solutions par ordre de pH croissant.
Pour une même concentration en soluté apporté, l'acide le plus fort
possède le plus petit pKa.
Chloreux < fluorhydrique < méthanoïque < acétique.
Quelles
sont les deux propriétés principales d'une solution tampon
?
Une solution tampon modère les variations de pH :
- suite à l'ajout modéré de base forte ou d'acide
fort.
- suite à une dilution modérée.
On dispose de solutions de même concentration : d'acide chlorhydrique,
d'acide acétique, d'ammoniac, de chlorure de sodium, d'acétate de
sodium, de chlorure d'ammonium, de potasse, de soude et d'acide
sulfurique. Indiquer
un moyen simple de préparer une solution tampon à pH = 4,7.
pKa (acide acétique /acétate) = 4,7.
Mélanger V mL de solution d'acide acétique à V mL d'une solution
d'acétate de sodium.
Titrer l'acide acétique par la soude avec arrêt à la demi-équivalence.
Définir
une espèce oxydante.
Un oxydant gagne un ou plusieurs électrons en se réduisant.
Parmi
les couples suivants, préciser quelle entité est l'espèce oxydante et
quelle entité est l'espèce réductrice.
(Mn2+ ; MnO4-
) : MnO4- est l'oxydant
et Mn2+ le réducteur.
(CO2 , C2O42-)
: CO2 est l'oxydant et C2O42-
le réducteur.
(Fe3+, Fe2+) : Fe3+
est l'oxydant et Fe2+ le
réducteur.
(SO42-, S2O82-)
: S2O82-
est l'oxydant et SO42-
le réducteur.
Equilibrer
l'quation ci-dessous :
Cr2O72-
+ 6Fe2+
+14H+--->
2Cr3+
+ 6Fe3+
+ 7H2O.
D'après le bilan du dosage de Fe2+ par du
permanganate de potassium :
MnO4- + 5Fe2+
+ 8H+ ---> Mn2+ +
5Fe3+ +4H2O.
Compléter
la formule suivante reliant le nombre de moles d'ion fer (II) au nombre
de moles d'ion permanganate.
n(Fe2+) = 5 n(MnO4-).
On cherche à doser les ions fer (II) dans une solution. On dispose de
dichromate de potassium et de thiosulfate de sodium.
E°(S4O62-
/ S2O32-)
=0,08 V ; E°(Cr2O72-/Cr3+)
= 1,36 V ; E°(Fe3+/Fe2+)
=0,77 V.
Un titrage nécessite une réaction rapide et totale. Fe2+
joue le rôle de réducteur ; il faut choisir un oxydant plus fort que Fe3+.
L'ion dichromate convient : E°(Cr2O72-/Cr3+)
>E°(Fe3+/Fe2+).
|
|
|
Réaction
de précipitation.
On
donne les produits de solubilité à 25°C de différents composés.
Ks(BaSO4) = 10-10
; Ks(Fe(OH)2) = 10-16
; Ks(Fe(OH)3) = 10-39
; Ks(Ni(OH)2) = 10-15.
Le
sulfate de baryum est-il considéré comme plutôt très soluble dans l'eau
?
Ks(BaSO4) = 10-10
=[Ba2+][SO42-]
= s2 ; s = 10-5 mol/L.
La solubilité est très faible.
On dispose de 2 solutions :
S1 : chlorure de fer (II) à 0,1 mol/L ; S2
: chlorure de fer (III) à 0,1 mol/L. On ajuste le pH à 2.
Y-a-t-il
précipitation dans les différentes solutions ? Justifier. Indiquer le
nom du composé qui précipite.
[Fe2+]i =0,1 mol/L ;
[HO-]i =10-12
mol/L ; Q r i =[Fe2+]i [HO-]i2
=0,1 *10-24 = 10-25,
valeur inférieure à Ks(Fe(OH)2).
Aucun précipité.
[Fe3+]i =0,1 mol/L ;
[HO-]i =10-12
mol/L ; Q r i =[Fe3+]i [HO-]i3
=0,1 *10-36 = 10-37,
valeur supérieure à Ks(Fe(OH)3).
L'hydroxyde de fer (III) précipite.
A
partir de quel pH, un précipité d'hydroxyde de nickel (II) commencera à
se former dans une solution à 0,1 mol/L en ion Ni2+
?
Ks(Ni(OH)2) = 10-15
=[Ni2+][HO-]2
; [HO-] = (10-15 / 0,1)½
=10-7 mol/L ; à partir de pH = 7, Ni(OH)2
précipite..
Indiquer
la composition de l'eau de Javel.
Solution basique d'hypochlorite de sodium et chlorure de sodium.
La réaction de l'eau de Javel avec un acide fort dégage un gaz très
dangereux.
Lequel ? Le dichlore.
|
|
|