Chimie
: concours
Technicien Montpellier 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Compléter
le tableau.
Nom
de l'atome
|
Symbole
|
Nom
de l'ion
|
Symbole
|
Rubidium
|
Rb
|
sulfate
|
SO42-
|
Platine
|
Pt
|
nitrate
|
NO3-
|
Radon
|
Rn
|
chrome (III)
|
Cr3+
|
Arsenic
|
As
|
cobalt (II)
|
Co2+
|
Sr
|
Strontium
|
hydrogénocarbonate
|
HCO3- |
Zirconium
|
Zr
|
perchlorate |
ClO4- |
Nom
des composés
|
Formule
|
Nom
des composés
|
Formule
|
permanganate
de rubidium
|
RbMnO4
|
chromate de plomb
|
PbCrO4
|
phosphate de chrome (III)
|
CrPO4
|
acide
acétique
|
CH3-COOH
|
Nitrite de
cobalt (II)
|
CoNO2)2
|
|
|
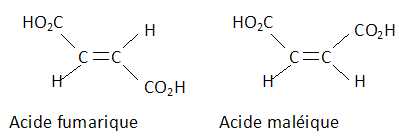
L'acide
fumarique et l'acide maléique sont respectivement les isomères E et Z
de l'acide but-2-ène dioïque
Donner
la formule brute de cet acide ; donner la représentation de Cram des
deux isomères et les identifier.
C4H4O4.
Un ester a pour formule C3H6O2.
Donner
les différentes formules semi-développées possibles, et nommer ces
esters.
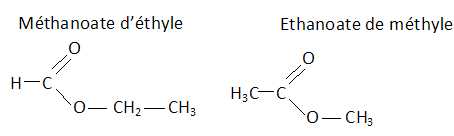
On prépare une solution aqueuse de
chlorure d’ammonium [NH4+
+ Cl- ] de concentration c = 0,010 mol . L-1,
de pH = 5,6. Le volume de la solution est V = 0,10 L.
Calculer
la concentration en ions oxonium.[H3O+]=
10-pH = 10-5,6 =2,5 10-6
mol/L.
NH4+ est un acide. Quelle est
sa base conjuguée ? NH3.
Ecrire
l’équation rendant compte de l’action de NH4+sur
l’eau. On nomme
(1) cette équation.
NH4+aq
+ H2O(l) = NH3aq + H3O+aq.
Calculer
le taux d’avancement final t de la
réaction (1). On pourra dresser un tableau d’avancement.
|
avancement
volumique (mol/L) |
NH4+aq |
+ H2O(l) |
= NH3aq |
+ H3O+aq |
| initial |
0 |
c |
solvant |
0 |
0 |
| équilibre |
x |
c-x |
x |
x = 10-pH |
t
= x / c = 10-pH/ c =2,5 10-6 /
0,010 =2,5 10-4.
Calculer
la constante d’équilibre de la réaction (1).
K = [NH3aq][H3O+aq] / [NH4+aq] =x2 /(c-x) =(2,5 10-6)2 / (0,010-2,5 10-6 )
=6,3 10-10.
|
| .
. |
|
|
Voici
le spectre du proton simplifié de la 4-hydroxy-4-méthyl pentan-2-one.
Donner
la formule semi-développée de la molécule étudiée.
Identifier
en les entourant sur la formule, les protons équivalents.
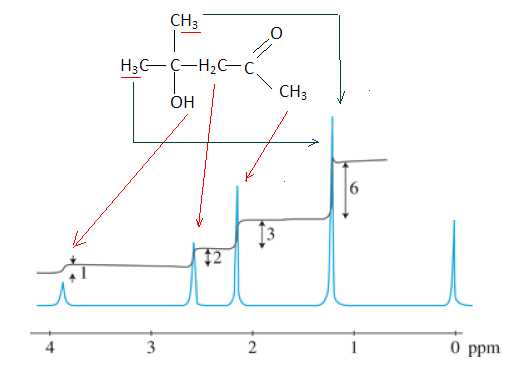
Sur
le spectre RMN, à quoi sert le produit présentant un pic à 0 ppm ? Quel
produit utilise-t-on le plus souvent ?
Le tétraméthylesilane donne un pic qui sert de référence.
|
.
|
|
On
considère la pile électrochimique : Ni / Ni2+ //
Ag+ / Ag où l’électrode d’argent constitue le
pôle positif. Le volume de chaque demi-pile est V = 1 000 cm3.
Les concentrations initiales en ions métalliques sont : c (Ni2+)
= 0,30 mol.L-1 et c (Ag+)
= 0,50 mol.L-1 .
L’électrode de nickel est plongée dans la solution de Ni2+
et a un volume de 1,0 cm3.
La pile débite un courant d’intensité I = 50 mA dans une résistance R.
-Masses molaires : MAg = 107,9 g.mol-1
; MNi = 58,7 g.mol-1 .
-La densité de l’argent est 10,5 et celle du nickel 8,9. La
masse volumique de l’eau est ρ = 1 000 kg. m-3.
- On note 1 faraday (1 F) la quantité d’électricité d’une mole
d’électrons : 1 F ≈ 96 500 C. mol-1.
Ecrire
l’équation de la réaction qui a lieu lorsque la pile débite.
L’une des deux électrodes diminue de volume. Laquelle?
Justifier.
L'ion argent Ag+ se réduit à la cathode positive
: Ag+aq + e- = Ag(s).
Le nickel s'oxyde à l'anode négative : Ni(s) = Ni2+aq
+2e-. La masse de cette électrode diminue.
Ni(s) +2Ag+aq = Ni2+aq
+2Ag(s).
Combien
de temps faut-il pour que cette électrode disparaisse complètement
?
Masse de nickel : m = 1,0*8,9 =8,9 g ; quantité de matière de nickel :
n=m / MNi =8,9 / 58,7 =0,15162 mol.
Quantiitéde matière d'électrons : 2n = 0,30324 mol ; quantité
d'électricité : Q = 0,30324 *96500 =2,926 104 C.
Dt
= Q / I =2,926 104 /0,050 ~5,9 105
s ou 1,6 102 heures.
Calculer
alors les concentrations finales des espèces en solution.
Quantité de matière d'ion nickel(II) ajouté : 0,15162 mol..
Quantité de matière initiale d'ion nickel (II) : 0,30 mol ; total :
0,4512 ~0,45 mol dans 1 L.
Quantité de matière d'ion argent disparu : 2*0,15162 =0,30324 mol..
Quantité de matière initiale d'ion argent : 0,50 mol ; bilan : 0,19676
~0,20 mol dans 1 L.
Calculer
le quotient de réaction final Q r,f.
Q r f =[Ni2+aq] f
/ [Ag+aq]2f =0,4512
/ 0,196762 =11,65 ~12.
La constante d’équilibre est K = 7,3 1034.
L’équilibre est-il atteint lorsque la pile cesse de fonctionner ?
Justifier.
Q r f < K, l'équilibre n'est pas atteint
lorsque la pile cesse de fonctionner. Lorsque l'équilibre est
atteint Q r f = K.
Voici les spectres IR de l’éther diéthylique et de l’éthanol :
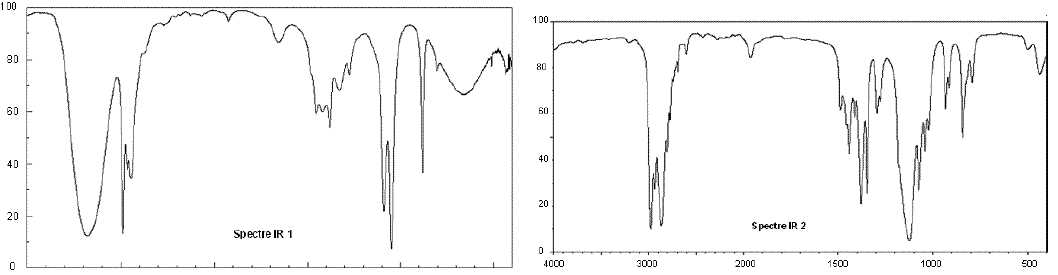
Quelle
donnée est représentée en ordonnée ? La transmittance.
Quelle
donnée est représentée en abscisse? Donner son unité. Le
nombre d'onde en cm-1.
Attribuer
à chacun des deux composés son spectre IR en justifiant une seule bande
caractéristique.
Spectre 1 : éthanol. Large et forte bande vers 3300 cm-1
due à OH lié par liaisons hydrogène.
Spectre 2 : éther diéthylique : bande caractéristique vers 1200 cm-1
due à deux liaisons C-O.
|
|
|
Dans 25,0
grammes de méthane, combien y a-t-il de molécules de méthane
?
Combien
y a-t-il d’atomes de carbone et d’hydrogène ? Nombre
d’Avogrado : 6,022 x 1023 mol -1.
Quantité de matière de méthane : m / M(méthane) = 25,0 / 16,0 =1,5625
mol.
Nombre de molécules de méthane n NA = 1,5625
*6,022 1023 =9,41 1023.
Nombre d'atomes de carbone : 9,41 1023. Nombre
d'atomes d'hydrogène : 4*9,41 1023 =3,76 1024.
Déterminez
en développant le calcul, le volume qu’occupe 1,00 mole de tout gaz
dans les conditions normales de température et de pression (CNTP).
Constante des gaz parfaits = 8,314 J.mol-1.K-1.
Pour un gaz parfait : Vm =nRT/P = 1,00 *8,314
*273 / (1,013 105 )=2,24 10-2
m3 mol-1 = 22,4 L mol-1.
Des
expériences ont permis de déterminer la structure de cristaux d’iodure
de césium sous une pression de 302 gigapascals (GPa).
Exprimer
cette pression en atmosphères et en millibars. 1 atmosphère standard = 1,013 x
105 Pa ;1 bar = 105
Pa.
302 GPa = 302 109 Pa =302 109
/(1,013 x
105 ) =2,98 106
atm = 2,98
106 bar = 2,98 109
millibars.
Entourer
la bonne réponse. Le dihydrogène est : toxique, inflammable,
corrosif
Citer
trois risques associés à l’utilisation d’une bouteille de 9 m3 (B50)
d’argon comprimé. Préciser les mesures de prévention adaptées à ces
risques.
Gaz
asphixiant ( aération des locaux ) ; risque éclatement bouteilles ou du
détendeur, maintenir une température inférieure à 40°C ; arrimer les
bouteilles en position verticale afin d'éviter leur chute.
Vous
réceptionnez une bonbonne de 50 litres d’azote liquide au
rez-de-chaussée de votre bâtiment de recherche. Que faites
vous pour la transporter jusqu’à votre laboratoire situé au quatrième
étage ?
Bouteille
arrimée en position verticale ; port de gants adaptés au gaz
cryogéniques et de chaussures de sécurité ; ne pas sopulever la
bouteille par le robinet ou le manodétendeur.

Donner la
signification des numéros pairs.
2 : dangers pour l'environnement ; 4 : inflammable ; 6 : toxique ; 8 :
cancérogène.
Vous devez manipuler de l’acide chlorydrique à 32%.
Donner
les numéros des deux pictogrammes figurant sur la bouteille. Quelles
précautions devez-vous prendre lors de la manipulation ?
5 : corrosif ; .9 : danger pour la peau, les yeux, les voies respiratoires.
Port de blouse, gants et lunette de protection.
Donner la
signification des acronymes suivants :
CHSCT : commission d'hygiène et décurité et des conditions de travail ; INRS : institut national de recherche et de sécurité
; AP : access point ( poit d'accès ) ; alcool pur.
DATI : dispositf d'alarme pour travailleur isolé. ; SST : sauveteur secouriste du travail ; EPI : équipement de protection
individuel ; DAE : défibrilateur automatique externe.
En
écrivant sa formule de Lewis prédire la configuration d’une molécule de
méthanal. Quel est
l’état d’hybridation de l’atome de carbone?
Sous
quel nom plus courant la molécule de méthanal est-elle connue
?
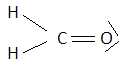 Hybridation
sp2 ; autre nom : formol. Hybridation
sp2 ; autre nom : formol.
|
|
|