Chimie : concours
Technicien Strasbourg 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Nomenclature.
Compléter
le tableau.
Nom
de l'atome
|
Symbole
|
Nom
de l'ion
|
Symbole
|
lithium
|
Li
|
sulfate
|
SO42-
|
azote
|
N
|
ammonium
|
NH4+
|
fluor
|
F
|
bichromate
|
Cr2O72-
|
magnésium
|
Mg
|
carbonate
|
CO32-
|
chrome
|
Cr
|
|
Or
|
Au
|
Nom
des composés
|
Formule
|
Nom
des composés
|
Formule
|
peroxyde
d'hydrogène
|
H2O2
|
acide
sulfurique
|
H2SO4
|
acétone
|
CH3-CO-CH3
|
acide
acétique
|
CH3-COOH
|
N,
N-diméthylformamide
|
(CH3)2N-CHO
|
|
|
Etat de
la matière .
Donner
la formule et l'état physique des composés suivants à température
ambiante et à pression ambiante.
Sodium Na ( solide) ; ddiode : I2 ( solide ) ; acéthylène : C2H2
( gaz ) ; diazote : N2 (gaz) ;
mercure : Hg (liquide ) ; acétate de sodium : CH3COONa (
solide ).
Unités et
conversion.
Quelle
est l'unité de mesure des grandeurs suivantes ?
Molarité : ( mol) ; densité : sans unité ; pression : ( Pa ; bar en
usage courant ) ; masse : kg ; force : (N).
Convertir
les grandeurs suivantes.
23 mm2 = 23 10-6 m2 ; 60 cm3
= 60 10-6 m3 ; 98 mg cm-3 = 98 10-3
kg L-1.
60 km/h = 60 /3,6 m/s = 16,7 m/s ; 1 bar ~105 Pa.
Réactions
chimiques.
Ecrire
et équilibrer les réactions chimiques suivantes.
C3H8 + 5O2 ---> 3CO2 + 4H2O.
H2SO4
+ 2NaOH ---> Na2SO4 + 2H2O.
MnO4-
+ 5Fe2+
+8H+---> Mn2+
+5Fe3+
+ 4H2O. (en milieu
acide ).
CH3COOH + CH3CH2CH2OH = CH3COO-CH2CH2CH3 + H2O.
Calcul de
rendement.
Soit la réaction suivante :
2Fe 2O 3 (s) + 3C(s) ---> 4Fe(s) + 3CO 2(g).
A partir de 15,0 g d'oxyde de fer on obtient 7,50 g de fer. M( Fe2O3)
= 159,6 g/mol ; M(Fe)=55,8 g/mol.
Calculer
le rendement.
Quantité de matière d'oxyde de fer : n =15,0 / 159,6 =9,40 10 -2
mol.
A partir de 9,40 10-2
mol d'oxyde de fer, on peut obtenir au mieux 2*9,40 10-2
=0,188 mol de fer, soit : 0,188*55,8 =10,5 g de fer.
Rendement : masse réelle / masse théorique = 7,50 / 10,5 =0,715 ( 71,5
%).
|
| .
. |
|
|
Donner la
signification des indications portées par cette burette graduée.
Volume total 25 mL ; graduation tous les 0,1 mL ; classe A ; volume
délivré en 30 s ; exactitude du volume à 20°C : ±0,05 mL.
Dans les conditions normales de température et de pression on désire
connaître la densité du dichlore.
Quelle formule
utilisez-vous ?
M=29 d ; M(Cl2) = 71 g/mol ; d = 71/29 = 2,9. Le dichlore
est plus dense que l'air.
Préparation
d'une solution.
On désire préparer une solution aqueuse de sel de calcium. La solution
a pour concentration 30 ppm. Le chlorure de calcium est commercialisé
sous forme de cristaux de pureté égale à 97 % par lot de 250 g. Le
technicien dispose d'une balance de gamme 0 - 250g et d'une
balance de précision ±0,00001 g ainsi que toute la verrerie classique
de laboratoire.
Quelle
est la masse de sel à peser pour réaliser 0,5 L d'une solution mère à
1000 ppm en calcium ?
1 ppm = 10-6 g / kg. 1000 ppm = 1,00 10-3 g/kg
soit 1,00 mg de calcium par kg de solution.
Masse de 1 L d'eau : 1,0 kg ; Pour préparer 0,5 L de solution
mère à 1000 ppm il faut peser 0,500 mg de calcium.
M( CaCl2) =40,08+2*35,45 =110,98 g/mol ;
il faut peser : 0,500*110,98 /40,8 =1,38 mg de chlorure de calcium.
Tenir compte de la pureté du solide commercial : 1,38 / 0,97 = 1,43 mg.
Peser 1,43 mg de chlorure de calcium à l'aide d'une balance de
précision. Verser dans une fiole jaugée de 0,500 L. Ajouter de l'eau
distillée pour dissoudre le solide et compléter jusqu'au trait de
jauge. Boucher et rendre homogène.
A partr de cette solution mère on prépare
1 L de solution étalon à 30 ppm.
Facteur de dilution : 1000/30 = 33,3.
Prélever 33,3 mL de la solution mère à l'aide d'une burette graduée ;
verser dans une fiole jaugée de 1,00 L ; compléter avec de l'eau
distillée jusqu'au trait de jauge.
|
.
|
|
Techniques de
séparation :
Quelle(s)
technique(s) permet(tent) de séparer :
Un solide d'un liquide : décantation, filtration.
Des solides de tailles différentes : tamisage.
Différents liquides non-miscibles : décantation ( ampoule à décanter ),
centrifugation.
Différents liquides miscibles : distillation.
Capacité
d'un récipient.
L'indication de la capacité volumique nominale d'un bécher s'est
effacée avec le temps :
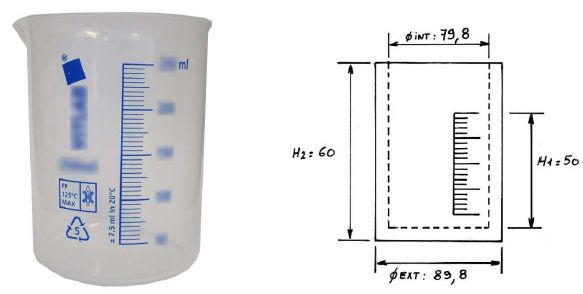
En
assimilant le bécher à un cylindre parfait et à l'aide la de cotation
ci-dessus (cotes en mm) retrouvez la capacité volumique nominale et
exprimez-la en mL.
V = pr2h =3,14 *
(79,8 10-3 /2)2 *50 10-3 =2,50 10-4
m3 = 250 cm3 = 250 mL.
Un technicien doit préparer 25 L d'une solution d'acide nitrique
à 1,00 mol/L. L'étiquette de la solution commerciale porte les
indications suivantes : 52,5 % en masse, densité d = 1,33 ; M=63,01
g/mol.
Quels
sont les EPI qu'il doit porter pour réaliser cette solution ?
Blouse, gants et lunette de protection.
Quel
volume de solution commerciale faut-il prélever pour réaliser 1 L
de solution molaire ?
Masse d'acide pur par litre de solution commerciale : 0,525*1,33 =0,698
kg = 698 g.
Concentration molaire de cette solution : 698 /63,01 =11,08 mol /L ;
facteur de dilution 11,08 ~11,1
Pour préparer 1 L de solution molaire, il faut prélever à l'aide d'une
pipette ou d'une burette graduée 11,1 mL de solution commerciale.
Verser dans une fiole jaugée de 1,00 L contenant 1/3 d'eau distillée.
Compléter jusqu'au trait de jauge avec de l'eau distillée. Boucher,
agiter pour rendre homogène.
Hygiène et
sécurité.
Que
signifie le sigle CMR ? Cancérogène, mutagène reprotoxique.
Certains
composés présentent un risque d'incendie parce qu'ils peuvent être
:
des carburants ; des espèces volatils inflammables.
Que
signifient les pictogrammes suivants ?

Que
doit-on faire en cas de brûlures légères par un acide ?
Laver à grande eau.
Vous préparez une solution approximativement molaire d'une
solution de soude en dissolvant des cristaux d'hydroxyde de sodium.
Quelle est la particularité de cette
dissolution ?
Cette dissolution étant exothermique, travailler en utilisant un bain
de glace. La solution est corrosive : coller l'étiquette ce sécurité
correspondante sur le flacon.
Donner
le mode d'évacuation approprié pour les déchets suivants.
Solution KCl à 0,1 mol/L : évier ; acétate d'éthyle : solvants non
halogénés ; solution contenant des ions Pb2+ : container
sels de métaux lourds.
Chloroforme : solvants halogénés ; flacon en verre ayant contenu
du méthanol : container spécifique pour déchets solides ; éther :
solvants non halogénés.
|
|
|
Vous
êtes chargé de commander un produit proposé par deux fournisseurs
différents. Lequel
choisir ?
Fournisseur A : 2,4-dichlorobenzoyl chloride 98 % : d = 1,49 ; 100 mL
pour 32,00 € TTC.
Fournisseur B : 2,4-dichlorobenzoyl chloride 98 % : d = 1,49 ; 100 g
pour 28,60 € TTC.
Fournisseur A
: la masse de 100 mL est m = 149 g soit 32,00 *100/149 = 21,48 € les
100 g.
La TVA est au taux de 20 %, quel est le prix
hors taxes ?
32,00 /1,2 = 26,67 € les 100 mL.
Votre consommation est de 250 mL par mois et vous devez avoir 3 mois de
stock.
Combien
de flacon commandez-vous tous les trois mois ? Quel budget HT cela
représente-t-il ?
Consommation en trois mois : 250*3 = 750 mL. Il faut donc commamder 8
flacons de 100 mL pour un montant HT de : 8*26,67 =213,36 €.
Votre responsable vous
demande de réaliser les tâches suivantes. Le temps pour effectuer
chaque tâche est indiqué en gras.
Tâche 1 : réception et rangement d'une commande : 40 min.
Tâche 2 : analyser le spectre d'un produit enregistré précédemment : 20 min.
Tâche 3 ; effectuer une synthèse : cette réaction dure 50 min ( tâche 3a) et ne nécessite
aucune attention particulière. Il faut néanmoins en plus, procéder aux
opérations suivantes :
tâche 3b : démarrage de la réaction 10
min.
Tâche 3c : traitement et isolation du produit 20 min.
Tâche 4 : établir une liste de verrerie à commander
suite à celle reçue en tâche 1 : 30 min.
Tâche 5 : faire une pause de 10 min.
Comment procéder en un minimum de temps ?
Tâche 1 ; tâche 3b ; pendant la durée de la tâche 3a , réaliser la
tâche 2 et la tâche 4 ; tâche 3c ; tâche 5 : durée totale :
2 h 10 min.
|
|
|