Physique, chimie
minérale. Concours
ITRF Rennes
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1-Electricité : (2 points)
Quelle est l’ordre de grandeur du courant qui traverse le corps humain
dont la résistance est 1600 ohms lorsqu’il est soumis à une tension de
400 V ?
I = U / R = 400 / 1600 = 0,25 A.
Electromagnétisme :
(7,5 points)
2.1 Compléter le
tableau suivant : 2 points (0,5 pt par réponse)
Longueur
d'onde dans le vide
|
<
10 pm
|
10
pm - 10 nm
|
10
nm - 400 nm
|
400
nm - 800 nm
|
800
nm-1 mm
|
Nom
de l'onde électromagnétique
|
Rayons
g
|
Rayons
X
|
ultraviolet
|
lumière
visible
|
infrarouge
|
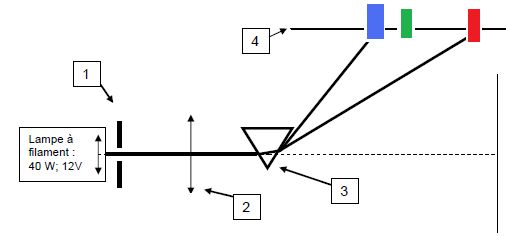
2.2 Un enseignant désire montrer à
ses étudiants le spectre de la lumière blanche.
2.2-a : Indiquez
deux dispositifs que l'on peut envisager ?
Décomposition
de la lumière blanche par un prisme ou par un réseau.
2.2-b : Décrire le
spectre observé ?
 Le prisme
peut être
remplacé par un réseau.
Le prisme
peut être
remplacé par un réseau.
La tache centrale de diffraction est
blanche ( superposition de toutes les radiations de la lumière blanche
). De
part et d'autre, on observe une alternance de taches sombres (
absence de lumière ) et de taches colorées. La radiation rouge est la
plus déviée.
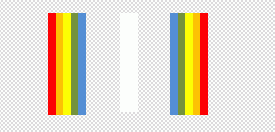
2.2-c : Quelle est
la grandeur associée à une couleur ? (1 point).
La fréquence en hertz est associée à une couleur.
2.3 Un
faisceau de lumière d’une lampe à incandescence donne une tache blanche
sur un écran qui
diffuse parfaitement toutes les lumières du spectre visible.
Entre la lampe envoyant la lumière blanche et l’écran, on place
successivement 3 filtres : un cyan, un
magenta et un jaune. Que voit-on alors sur l’écran ? (1 point).
Le filtre cyan arrête sa couleur complémentaire, le rouge. Le filtre
magenta arrête sa couleur complémentaire, le vert. Le filttre
jaune arrête sa couleur complémentaire, le bleu.
2.4 L’aniline a
pour formule C6H7N. Le spectre UV-visible de
l’aniline est donné ci-dessous.
Dans quel domaine de longueur d’onde l’aniline absorbe-t-elle ?
Cette molécule est-elle colorée ? (1,5 points).
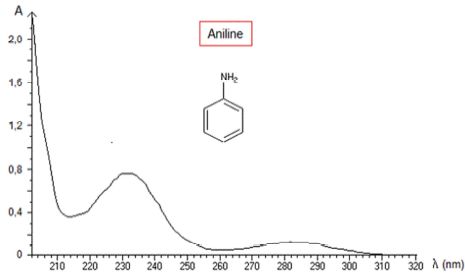
L'aniline présente un maximum d'absorption dans l'UV vers 230 nm. C'est
un liquide incolore.
|
| .
. |
|
|
3-Optique : (5,5 points)
3.1 : Comment
s’appelle la grandeur physique associée à une lentille ? Quelle en est
l’unité ? (1 point).
La vergence est exprimée en dioptries.
3.2 : Compléter le tableau : (2 ,5
points).
Lentille
|
L1
|
L2
|
L3
|
Indication
|
+8
d
|
+3
d |
-3
d |
nature
|
Convergente
|
Convergente
|
Divergente
|
Distance
focale (m)
|
1/8
= 0,125
|
1/3
~0,333
|
-0,333
|
3.3 : Comment distinguer les deux
types de lentilles ? (1 point)
Une lentille convergente est bombée au centre et plus mince sur les
bords ; c'est l'inverse pour une lentille divergente.
3.4 : Expliquer
pourquoi en regardant un texte à travers une lentille, on peut faire la
différence entre
les deux types de lentilles ? (1 point).
En regardant un objet proche avec une lentille convergente fonctionnant
en loupe, on observe une image virtuelle plus grande que l'objet. Une
lentille divergente ne peut pas être utilisée en loupe.
|
|
|
|
Chimie minérale 50 points.
1- Structure de la
matière (10 points)
1.1 : Donner le nom
des éléments ou ions suivants. (3 points).
Al : aluminium ; Si : silicium ; P : phosphore ; Na : sodium ; Br-
: bromure ; NO3- : nitrate ; SO42-
: sulfate ; Cl- : chlorure ;
PO43- : phosphate ; NH4+ :
ammonium.
1.2 : Donner les
symboles chimiques correspondants. (2 points).
Oxyde de magnésium : MgO ; chlorure de cuivre II : CuCl2 ;
oxyde de germanium : GeO2 ; carbure de silicium : SiC
; oxyde de bore : B2O3.
1.3 : Parmi les
affirmations suivantes, préciser lesquelles sont vraies et lesquelles
sont fausses. (3
points).
Selon Pauling, l'électronégativité d'un élément est sa tendance à
attirer à lui les électrons de la liaison. Vrai.
L'azote est plus électronégatif que l'oxygène. Faux.
Le sodium est plus électronégatif que le soufre. Faux.
Dans le groupe n°1, l'électronégativité croît lorsque le numéro
atomique augmente. Faux
Dans la période n°2, les rayons atomiques diminuent lorsque le numéro
atomique croît. Vrai.
Le fluor fait partie des halogènes. Vrai.
1.4 : Préciser à quelle classe appartiennent les matériaux suivants (2 points).
PVC : polymères ; alumine : céramique ; béton armé : composite ; acier : métaux et alliages.
2 : La réactivité en chimie minérale (17 points)
2.1 : La décomposition thermique de l'oxalate de calcium (5 points)
CaC2O4 se décompose par pyrolyse en 2 étapes. La 1ère
étape correspond à une perte de masse de 21,875 % ; la seconde a une
perte de masse de 34,375 %. On donne les masses molaires atomiques
suivantes :
MCa = 40 g.mol-1 MC = 12 g.mol-1 MO = 16 g.mol-1.
Proposer un schéma de décomposition thermique.
M(CaC2O4) =128 g/mol ; M(CaCO3) = 100 g/mol ; M(CaO) = 56 g/mol.
Perte de masse pour une mole d'oxalate de calcium : 128*0,21875 = 28 g.
Oxydation : CaC2O4 (s)+½O2(g) --> CaCO3(s) +CO2 (g).
Seconde perte de masse : 128*0,34375 =44 g.
CaCO3(s) ---> CaO(s)+CO2 (g).
2.2 : Les complexes (1 point)
L'hydrolyse d'une solution de chlorure cuivrique conduit à la formation
d'un complexe métallique de cuivre divalent de coordinance 6. Ecrire
l'équation chimique correspondante.
CuCl2 +6H2O--->Cu(H2O)62+ + 2Cl-.
2.3 : Réactions redox (6 points)
Parmi les couples suivants, préciser quelles sont les entités oxydantes et réductrices. (3 points)
MnO4- ( oxydant ; MnO2 ( réducteur) ; NO3- ( oxydant) ; N2 ( réducteur) ; SO42- ( réducteur) ; S2O82- ( oxydant).
On cherche à doser une solution aqueuse d'ions Fe2+. On
dispose pour cela de solutions aqueuses de bichromate de potassium et
de thiosulfate de sodium. A partir des potentiels standards suivants,
préciser quelle solution vous allez utiliser et écrire l'équation
chimique du dosage. (3 points)
6Fe2+aq =6 Fe3+aq + 6e-.
Cr2O72- aq + 14H+aq + 6e-= 2Cr3+aq +7H2O.
Cr2O72- aq + 14H+aq + 6Fe2+aq= 2Cr3+aq +7H2O +6 Fe3+aq.
2.4 : Réactions de précipitation (5 points)
Le tableau ci-dessous résume les produits de solubilités à 25°C des deux composés.
BaSO4 : Ks1 = 10-10 ; Ni(OH)2 : Ks2 =10-15.
En assimilant activité et concentration, calculer la solubilité de ces
deux composés dans une solution aqueuse neutre et en déduire lequel des
deux est le plus soluble.
Ks1 =[SO42-][Ba2+] = s12 ; s1 = 10-5 mol/L.
Ks2 =[Ni2+][HO-]2 ; [Ni2+] = 10-15 / 10-14 = 0,10 mol/L ; le plus soluble.
|
|
|
|