Chimie générale.
Concours ITRF Poitiers 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1-a- Quel est le nom des réactifs suivants ?
KBr : bromure de potassium ; HBr bromure d'hydrogène ; MgSO4 : sulfate de magnésium ; Br2 : dibrome.
1-b- Donner le symbole des éléments suivants :
Sodium : Na ; potassium : K ; manganèse : Mn ; azote : N.
1-c- Donner le nom des ions suivants :
NH4+ : ammonium ; OH- : hydroxyde ; H- : hydrure ; Cl- : chlorure.
1-d- Dans quel état de la matière se trouvent les réactifs suivants (pression atmosphérique et température ambiante) ?
NH3 : gaz ; HCl : gaz ; Br2 : liquide ; Na2SO4 : solide.
1-e- Quel est le nom des composés organiques suivants ?
HOAc : acide éthanoïque ; EtOAc : acétate d'éthyle ; (BuO)3PO : tributyle phosphate ;
tBuOH : 2-méthylpropan-2-ol.
2- Chimie organique
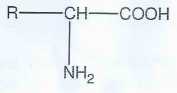
2-a- Ce protocole de synthèse permet de transformer un acide a-aminé en l’acide a-bromé correspondant. Quelles sont les deux fonctions organiques présentes dans un acide a-aminé ?
Une fonction acide carboxylique et une fonction amine primaire portées par le même carbone.
2-b- Citez quatre autres fonctions organiques :
alcool, cétone, aldehyde, amide, ester.
2-c- Écrire la formule générale semi-développée d’un acide a-aminé ?
 2-d- Les acides a-aminés sont les composants d’une grande famille de macromolécules naturelles : laquelle ?
2-d- Les acides a-aminés sont les composants d’une grande famille de macromolécules naturelles : laquelle ?
Les protéines.
2-e- L’acide L-aspartique est un des 22 acides a-aminé
naturels. Selon la nomenclature de l’IUPAC (International Union of Pure
and Applied Chemistry), il s’agit de l’acide (2S)-2-aminobutanedioïque.
Ecrire sa formule semi-développée.
|
| .
. |
|
|
2-f- La réaction mise en jeu est une diazotation/bromation qui peut être schématisée ainsi :
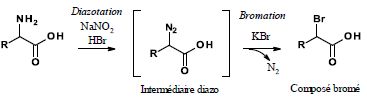
A quelle grande famille appartient cette réaction dans laquelle un composé diazo est transformé en composé bromé ?
Attaque nucléophile de l'amine sur l'agent nitrosant électrophile.
Quel est l’électrophile ? L'ion nitrosium NO+.
Quel est le nucléophile ? L'atome d'azote.
Quelle est la force motrice de cette réaction ?
Le diazote est un bon groupe partant. Le carbocation résultant est stabilisé par résonance.
2-g- Traduire en français le protocole général d’a-bromation d’acides
Avant la préparation des milieux acides, HBr concentré ( 48 % aq) est
lavé deux fois avec du phosphate de tributyl ( 5 %) pour éliminer toute
contamination avec le dibrome. La disparition complète de la couleur
indique l'élimination complètre du dibrome.
Dans un ballon tricol de 500 mL muni d'une agitation,
introduire KBr ( 3,7 équivalent) et 0,75 mol de HBr aq ( 4,4
équivalent). Après refroidissement à -7°C, 1,9 équivalent de nitrite de
sodium est ajouté en une seule fois. Cette opération est suivie de
l'addition d'un aminoacide ( 1 équivalent ) à chaîne latérale(
groupe carboxyle ) protégée tout en maintenant le mélange entre -4 et
-7°C.
Le mélange réactionnel est agité vigoureusement pendant 1,5 h puis
on extrait avec l'éthanoate d'éthyle, préalablement refroidit à
0°C ( 3 fois 200 mL). Les phases organiques regroupées sont lavées avec
de la saumure ( 2 fois 150 mL) , séchées sur MgSO4 anhydre
et concentrées par évaporation sous vide. Après purification, 15 mg du
produit est convertit en son ester méthylé avec CH2N2 et analysé par comparaison avec un énantiomère chiral pur par HPLC ou GC.
|
|
|
|
2-h- Pourquoi un ballon réactionnel à fond sphérique est-il préconisé ici ?
Le ballon à fond sphérique épouse parfaitemant la forme du bain
réfrigérant ; de plus il est préconisé lors d'une évaporation sous vide.
2-i- Qu’est-ce-que la saumure ? Pourquoi utilise-t-on cette solution pour terminer un procédé d’extraction ?
La saumure est une solution concentrée en chlorure de sodium. Les produits organiques sont insolubles dans une saumure.
2-j-
Votre collaborateur souhaite obtenir 10 g d’acide
(2S)-2-bromo-4-tertbutylcarboxylbutanoïque (1). Compte tenu du
rendement de la réaction, quelles sont les quantités de réactifs à
prévoir ? Remplir le tableau suivant.
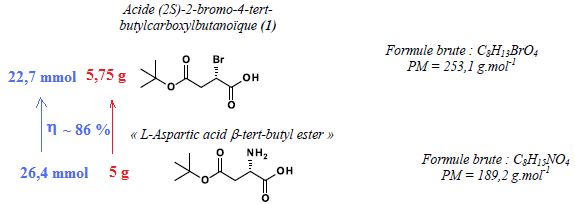
10 g de (1) correspond à 10 /253,1 = 39,5 mmol. Il faut donc partir de
: 39,5 /0,86 = 46 mmol de L aspartic acid ß-tert-butyl ester.
Réactif
|
Proportion
|
Quantité molaire
( mmol)
|
Quantité nécessaire
|
KBr
|
3,7 équi
|
170
|
119*0,17 ~ 20 g
|
HBr 0,75 M
|
4,4 équi
|
202
|
0,202*80,9 ~16 g ( ~16 mL)
|
NaNO2
|
1,9 équi
|
46*1,9 =87,4
|
69*0,202~14 g
|
| L aspartic acid ß-tert-butyl ester |
1,0 équi
|
46
|
189*0,046 ~8,7 g
|
2-k- La solution aqueuse de HBr à 0,75 mol.L-1 doit être préparée à partir d’une solution aqueuse commerciale de HBr à 48% (en masse)
Comment procéder pour préparer 1 L de la solution diluée souhaitée ? On donne : densité de cette solution : d = 1,48.
Masse de HBr dans la solution commerciale : m=1,48*0,48 = 0,71 kg = 710 g
Quantité de matière HBr : n = m / M = 710 / 80,9 = 8,8 mol dans un litre.
Facteur de dilution : F = 8,8 / 0,75 = 11,7.
Prélever 11,7 mL de solution commerciale à l'aide d'une pipette graduée
; verser dans une fiole jaugée de 1 L contenant un tiers d'eau
distillée. Compléter jusqu'au trait de jauge avec de l'eau distillée.
Agiter pour rendre homogène.
2-l- La réaction
est manifestement exothermique et un bain froid doit être préparé afin
que la température du milieu réactionnel soit comprise entre -4°C et
-7°C. Vous ne disposez pas de cryostat. Comment obtenir cette
température ?
Mélange de glace et de saumure.
2-n- L’acide
(2S)-2-bromo-4-tert-butylcarboxylbutanoïque souhaité est purifié par
chromatographie sur gel de silice. L’éluant préconisé est un éluant
ternaire. Indiquer cet éluant. Classer les trois composants de cet
éluant par ordre de polarité croissante.
Ether de pétrole ; acétate d'éthyle ; acide acétique.
2-o- Au
laboratoire, il n’y a pas d’éther de pétrole. En revanche, les solvants
suivants sont disponibles : acétone, éther de diéthyle, cyclohexane et
dichlorométhane. Lequel de ces quatre solvants pourrait être utilisé
pour remplacer l’éther de pétrole ?
Le cyclohexane.
|
|
|
3- Analyses chimiques.
3-a- Que signifie
l’abréviation « ee » ? Quel est le stéréoisomère majoritaire obtenu
selon ce protocole ? Donner la définition de l’ee dans ce cas ?
"ee" : excès énantiomérique. ee = |h+-h-)*100 où h+ et h- désignent les fractions molaires des énantiomères dextrogyre et lévogyre.
ee = 98 % dans ce cas. Le stéréoisomère majoritaire est le L.
3-b- La pureté énantiomérique des acides a-bromés
obtenus selon ce protocole est déterminée, après dérivation en ester de
méthyle correspondant, par GC chirale ou par HPLC chirale.
On rappelle : GC = Gas Chromatography = Chromatographie en Phase Gazeuse
HPLC = High Pressure Liquid Chromatography = Chromatographie en Phase Liquide sous Haute Pression
Pour une analyse par GC, compte tenu de l'appareil disponible au
laboratoire, la concentration de l'échantillon analytique doit être de
1 mg/mL (1000 ppm).
Quelle est la concentration en kg/L d'une solution à 1 ppm ?
10-6 kg dans 1000 mL soit 10-3 kg par litre.
3-c- Quelle est la précision minimale de la balance nécessaire pour préparer un échantillon analytique destiné à une analyse GC ?
3-f- Dans le cas de
l’acide (2S)-2-bromo-4-tert-butylcarboxylbutanoïque souhaité, la pureté
énantiomérique est déterminée par GC. Pour la colonne préconisée,
quel(s) paramètre(s) pourriez-vous modifier pour diminuer le temps
d’analyse ? Dans quel sens ?
Si on privilégie le temps d'analyse on utilise des colonnes courtes, mais la résolution chute.
3-h- Si l’analyse
GC dure 1h, quelle est la température du four à la fin de l’analyse
réalisée dans les conditions indiquées dans cet article ?
Température initiale 100 °C ; diminution 1°C par minute ; température au bout d'une heure : 40°C.
3-i- L’acide (2S)-2-bromo-4-tert-butylcarboxylbutanoïque souhaité a été caractérisé par RMN. Les spectres en 1H et 13C ont été décrits dans l’article. Dans la description du spectre dH, que signifient s, dd ? A quoi correspond J ? Quelle est son unité ?
s : singulet ; dd : doublet de doublet ; J : couplage en Hz.
3-j- L’acide
(2S)-2-bromo-4-tert-butylcarboxylbutanoïque souhaité a également été
caractérisé par IR. Que signifie « neat » et pourquoi est-ce possible
de faire l’analyse ainsi ?
Des composés organiques liquides peuvent être examinés directement sous forme de film mince entre deux plaques de NaCl.
3-k- A quelles fonctions organiques correspondent les 2 bandes caractéristiques indiquées pour décrire le spectre IR obtenu.
3200 cm-1 : OH du groupe COOH ; 1729 cm-1 : vibration C=O du groupe carboxyle.
|
|