Chimie organique.
Concours ITRF Poitiers 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. Préparation de
la 4-méthylacétophénone.

1) Dessiner
le montage de préparation de la 4-méthylacétophénone en prenant soin
d’identifier les éléments constitutifs et en précisant le sens de
circulation des fluides.
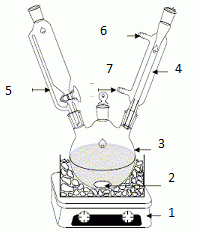 |
1 :
agitateur magnétique ( agitation du milieu
réactionnel )
2 : turbulent magnétique ( assure l'agitation du milieu réactionnel)
3 : ballon
tricol
4 : réfrigérant
à eau ( condense les vapeurs qui retombent dans le
milieu réactionnel)
5 : ampoule de
coulée ( ajouter lentement un réactif )
7 : entrée de
l'eau ; 6 : sortie de l'eau. |
2)
Donnez la définition d’un catalyseur, quel est son rôle ?
Un cattalyseur accélère la vitesse d'une réaction thermodynamiquement
possible. Dans certains cas, lorsque deux issues sont possibles, le
catalyseur peut orienter la réaction.
3)
Quelles précautions prenez-vous pour effectuer cette manipulation ?
Port de blouse, gants et lunette de protection.
Eviter la présence de toute flamme, le toluène est inflammable.
Eviter toute trace d'eau.
4)
Quel produit utilisez-vous, dans le piège, pour neutraliser le chlorure
d'hydrogène gazeux ?
Faire barboter le chlorure d'hydrogène
dans une solution d'hydroxyde de sodium.
5) Comment
vérifiez-vous, à la fin de la réaction, qu'il n'y a plus de dégagement
gazeux ?
Le pH de la solution de soude, où barbote HCl, n'évolue plus.
6)
Calculer en masse (g) ou en volume quand il s'agit de liquides (mL),
les quantités de réactifs nécessaires à cette synthèse. Donner les
détails des calculs.
Toluène :
358 mmol ; M = 92,14 g/mol ; densité = 0,867.
masse : 0,358 *92,14 = 32,98 g ; volume : 32,98 / 0,867 = 38,0 mL.
AlCl3
:169 mmol ; M = 133,94 g/mol ; masse : 0,169 *133,94=22,6 g.
Anhydride acétique
: 75 mmol ; M = 102,08 g/mol ; densité 1,08.
Masse : 0,075*102,08=7,656 g ; volume : 7,656 / 1,08 =7,1 mL.
7) Lors de
l’extraction à l’éther diéthylique, où se situe la phase aqueuse ?
La phase aqueuse, la plus dense, se situe au dessous de la phase
organique.
8) La
4-méthylacétophénone est un composé ayant plusieurs isomères possibles.
Donner la définition d’un isomère.
Des isomères possèdent la même formule brute, mais des formules
développées ou stéréochimiques différentes.
9) Dessiner tous
les isomères possibles de la méthylacétophénone.

|
| .
. |
|
|
10) Le produit final majoritaire est
la 4-méthylacétophénone, pourquoi ce composé est-il majoritaire ?
La position ortho est encombrée. par le groupe méthyle.
11) Il
faut veiller à ce que la température de réaction ne dépasse pas 90°C,
que peut-il se passer si l’on chauffe trop le milieu réactionnel ?
La température d'ébullition du toluène sous un bar est 111°C. En
chauffant trop, une partie du toluène se trouve sous forme vapeur.
12) Conventionnellement on peut
représenter ainsi AlCl3. quelle est la signification du
symbole au-dessus de l’atome d’aluminium, et quelle propriété y est
associée ?
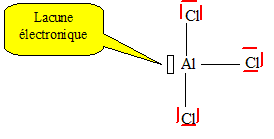
Du fait de la lacune
électronique, AlCl3 est un acide de Lewis, accepteur de
doublet électronique,
catalyseur dans la réaction de Friedel et Crafts.
13) Quelle est la
signification des pictogrammes suivants ?

|
|
|
|
14) Jusqu’au 1er juin 2015, on
trouve sur les emballages de produits chimiques les phrases R1 à R68 et
S1 à S64. A quoi correspondent-elles ? Et par quoi seront-elles
remplacées ?
R1 à R68 :Phrases de risques et S1 à S64 les conseils de prudence.
Le réglement CLP définit les règles européennes de classification,
d'étiquettage et d'emballage des produits chimiques.
Pour
vérifier l’obtention du produit final, la 4-méthylacétophénone, on fait
réaliser aux étudiants un spectre infra-rouge.
15) Expliquer
brièvement le principe de cette analyse.
La
Spectroscopie Infrarouge est basée sur l'absorption d'un rayonnement
infrarouge par le matériau analysé. Elle permet via la détection des
vibrations caractéristiques des liaisons chimiques entre deux atomes
d'effectuer l'analyse des fonctions chimiques.
Le spectre infra-rouge du produit obtenu à la fin de la réaction est le
suivant :
16) Quelle est la
signification des légendes « Wavenumbers » et « Transmitance »
Transmittance : fraction de l'intensité transmise par rapport à
l'intensité incidente exprimée en pourcentage.
Nombre
d'onde en cm-1, inverse d'une longueur d'onde.
17)
Identifier sur le spectre les différents groupes fonctionnels.
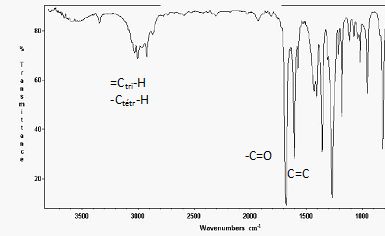
Quelles autres techniques analytiques pourriez-vous proposer pour
déterminer :
18) La pureté du
produit obtenu ?
Chromatographie, mesure du point de fusion d'un solide.
19) Sa structure
chimique ?
RMN du proton 1H et spectrographie de masse.
|
|
|
|