Chimie des
solutions.
Concours ITRF Poitiers 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. Titrage
acido-basique.
Dosage pH-métrique d'un mélange HCl + NH4Cl par NaOH.
pKa( NH4+ / NH3) = 9,2
Détermination
de la concentration de la solution titrante.
La concentration de la soude se situe entre 0,08 et 0,12 mol/L.
a. Pourquoi le
titre de la soude n'est-il pas stable dans le temps ?
Le
dioxyde de carbone de l'atmosphère est soluble dans l'eau. Il réagit
avec les ions hydroxyde. La solution de soude est carbonatée et sa
concentration change.
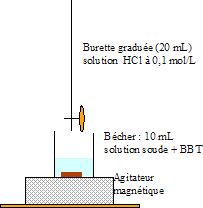
b.
Schématiser le montage pour titrer la solution de soude.
c. Proposer un protocole pour titrer
la solution de NaOH.
Remplir la burette avec la solution titrante HCl.
Prélever 10 mL de solution de soude à l'aide d'une pipette jaugée,
verser dans le becher et ajouter quelques gouttes de BBT. Mettre en
route l'agitation.
Ajouter goutte à goutte la solution titrante jusquau changement de
couleur de l'indicateur coloré.
Etude théorique du dosage du
mélange HCl + NH4Cl par NaOH :
a. Donner l'allure
de la courbe de titrage pH-métrique et indiquer le nombre de sauts de
pH.
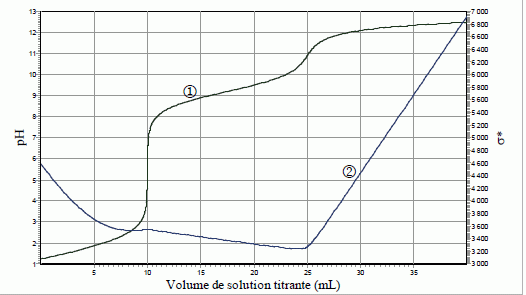 Courbe 1 : dosage
pHmétrique ; courbe 2 : dosage conductimétrique.
Courbe 1 : dosage
pHmétrique ; courbe 2 : dosage conductimétrique.
b.
Ecrire les équations de dosage correspondant à chaque saut.
1er saut : H3O+aq + HO-aq
---> 2H2O(l)
Second saut : NH4+aq +HO-aq
---> NH3aq +H2O(l).
c. Etablir les relations à
l'équivalence permettant de déterminer les concentrations en HCl et NH4Cl.
Ve
: volume de la prise d'essai ; Véqx, volumes équivalents
avex x en référence au saut de pH ; Cb : concentration de la
soude.
[HCl] Ve = Cb Véq1 ; [HCl]
= Cb Véq1 / Ve
;
[NH4Cl] Ve = Cb (Véq2
-Véq1) ; [NH4Cl]
= Cb (Véq2
-Véq1) / Ve.
|
| .
. |
|
|
3. Protocole du dosage et préparation
de la salle de TP.
On réalise le titrage pH-métrique du mélange HCl + NH4Cl par la
solution de NaOH titrée précédemment.
Le mode opératoire est le
suivant :
- Prélever un volume de prise d’essai = 10 mL du mélange HCl + NH4Cl
- Ajouter 10 mL d’eau distillée
- Titrer par la solution de NaOH de concentration Cb = 0,085
mol/L
- Tracer la courbe de titrage et repérer les sauts de pH
a) Pourquoi ajouter
de l’eau distillée dans le mélange réactionnel ?
Il faut immerger correctement l'extrémité de la sonde du pHmètre.
b) Cet ajout d’eau distillée a-t-il
une influence sur le dosage ? Si oui, sur quel paramètre ?
Cet
ajout n'a pas d'influence sur les volumes équivalents. Le pH du second
point d'équivalence sera légèrement modifié ainsi que le pH initial.
c)
L’exploitation de la courbe de titrage permet de déterminer les volumes
équivalents suivant : Veq1 = 2,8 mL et Veq2 = 7,5
mL. Déterminer les concentrations en HCl et en NH4Cl.
[HCl] = Cb
Véq1 / Ve
=0,085 *2,8 / 10 = 0,0238 ~0,024 mol/L.
[NH4Cl] = Cb (Véq2 -Véq1)
/ Ve = 0,085(7,5-2,8) /10 =0,040 mol/L.
d) Lister le matériel nécessaire
pour la mise en place du poste de dosage du mélange d’acides.
Burette graduée 20 mL ; pipette jaugée de 10 mL, béchers ; pHmètre +
sonde ; pisette eau distillée ; éprouvette graduée ; agitateur
magnétique ; solution de soude et solution du mélange d'acides.
|
|
|
|
II. QCM.
KMnO4 est un oxydant ( vrai ) ; réducteur ; acide.
La force d'un oxydant est déterminée par : son potentiel ( vrai ) ; sa
concentration ; sa charge électrique.
La force des oxydants est généralement plus forte en milieu : acide (
vrai) ; neutre ; basique.
Lors
du dosage d’une solution d’eau oxygénée par du permanganate faut-il………
la solution ? acidifier ( vrai), chauffer ; agiter ( vrai).
Un titrage oxydant-réducteur répond à la loi ou au théorème ou à
l’équation de ? Beer-Lambert ; Biot ; Nernst ( vrai).
Une
solution 1M d’acide sulfurique correspond à une solution : 1N; 2N (
vrai).
Une mesure de pH dépend de : la concentration ( vrai) ; du nombre de
moles.
Un acide peut être dosé par : pH-métrie ( vrai) ; conductimétrie (
vrai) ; oxydo-réduction.
Une solution tampon se prépare à partir d’un (une) même …… d’acide et
de base conjuguée. ( volume ; nombre de moles ( vrai) ; concentration.
Une mesure de conductance dépend de : la température ( vrai) ; la
pression ; du volume.
La solubilité d’un composé dépend de :la température ( vrai) ; la force
ionique ; du pH ( vrai).
Un ion commun va ……la solubilité d’un composé : augmenter ; diminuer (
vrai).
En général, si le pH augmente, la solubilité d’un composé : augmente ;
diminue ( vrai).
L'activité d'un solide est égale à : sa concentration ; son nombre de
moles ; 1 (vrai).
La solubilité de la chaux dans l’eau à 20°C est de quel ordre de
grandeur ? g/L (vrai) ; mg/L ; µg/L.
III. Rangement des
produits chimiques.
Acide nitrique 69% : armoire individuelle, non métallique aérée
avec bac de rétention.
Acide sulfurique 98% ; acide chlorhydrique 37 % : armoire non
métallique aérée avec bac de rétention, ne pas mélanger avec les bases.
Permanganate de potassium : armoire contenant uniquement des oxydants,
le plus loin possible des réducteurs.
Dichromate de potassium :
armoire des oxydants, armoire fermée à clef.
Chlorure de sodium,
hydroxyde de sodium 0,1 M. Libre accès.
Sélénium 99,99 % : armoire fermée à clef
|
|
|
|