Chimie
organique. Concours
ITRF Rennes
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. Nomenclature. (5 points)
Donner la formule semi-développée.
Acétone : CH3-CO-CH3. Chloroforme : CHCl3. 2-méthylpropan-2-ol : (CH3)3C-OH.
Triéthylamine : (CH3-CH2)3N. Acétamide: CH3-CO-NH2.
2 -Addition de HBr sur un alcène (5 points)
L’addition
de l’acide bromhydrique sur un alcène conduit à la formation d’un
composé monobromé de masse molaire M=137g/mol. Données : H :1g/mol C :
12g/mol Br : 80g/mol
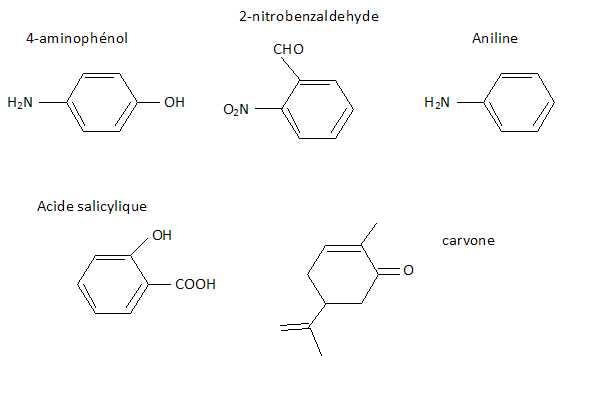
2.1 : Donner la formule brute du composé monobromé (1 point)
Formule brute CxH2x+1Br : M = 12x +2x+1 +80 = 14x +81 = 137 ; x = 4. C4H9Br.
2.2 : Quels sont les différents isomères de constitution possibles ? Donner pour chacun d’eux la
formule semi-développée correspondante et son nom. (2 points)
CH3-CH2-CH2-CH2Br 1-bromobutane. CH3-CH2-CHBr-CH3 2-bromobutane.
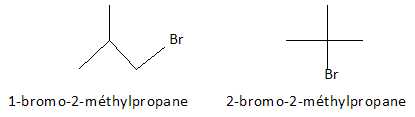
2.3 : L’un des isomères possède un carbone asymétrique. Quel type d’isomérie A1 présente–il ?
Donner une représentation des stéréoisomères correspondants. (1 point).
Enantiomères.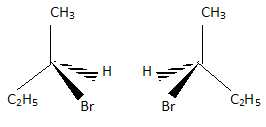
2.4 : Donner la structure du ou des alcènes permettant l’obtention de cet isomère A1. Indiquer la
configuration s’il y a lieu. (1 point)
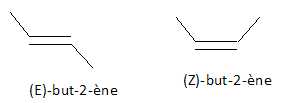
|
| .
. |
|
|
3 – Hydrodistillation des clous de girofle (20 points)
Pour extraire l'huile essentielle des clous de girofle, dont le principal constituant est l'eugénol,
on
introduit dans un ballon 100 mL d'eau distillée, 5 g de clous de
girofle et quelques morceaux de pierre-ponce. On met en place le
montage d'hydrodistillation, puis on porte à ébullition jusqu'à
recueillir 30 à 40 mL de distillat dans un erlenmeyer. On transvase le
contenu de l'erlenmeyer dans une ampoule à décanter. On ajoute 10 mL de
dichlorométhane, puis on agite vigoureusement l'ampoule en dégazant
régulièrement. Pour faciliter l'extraction de l'eugénol, on ajoute
environ 50 g de chlorure de sodium au distillat. On agite jusqu'à
dissolution et on laisse décanter son contenu.
Densité et miscibilité à l'eau de quelques solvants organiques.
| à 25°C |
Cyclohexane | dichlorométhane | Ethanol |
| Densité par rapport à l'eau |
0,89 | 1,34 | 0,78 |
| Miscibilité à l'eau |
Faible | faible | très grande |
Solubilité de l'eugénol dans différents solvants.
| Solvant | eau | eau salée | cyclohexane | éthanol | dichlorométhane | | Solubilité | faible | très faible | grande | grande | grande |
3.1 : Faire le schéma expérimental de l’hydrodistillation (3 points).
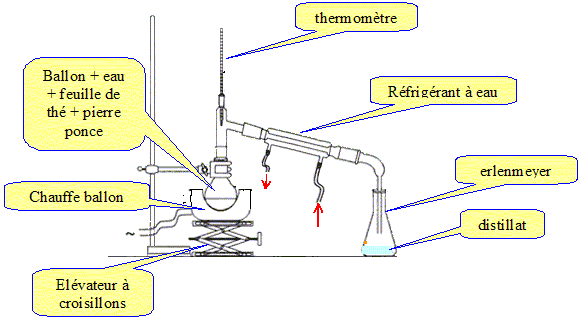
3.2 : Justifier à l'aide des tableaux de données qu'il y a deux phases, l'une que l'on nommera phase
organique et l'autre phase aqueuse dans l’ampoule à décanter. (1 point).
Le
dichlorométhane et l'eau sont faiblement miscibles. L'eugénol est très
soluble dans le dichlorométhane et faiblement dans l'eau.
3.3 : La phase inférieure dans
l'ampoule est-elle la phase aqueuse ou la phase organique ? Justifier à
l'aide des tableaux de données. (1 point).
Le solvant le plus dense ( le dichlorométhane) occupe la partie inférieure de l'ampoule à décanter.
|
|
|
|
3.4 : Après agitation, dans quelle phase se trouve l'eugénol ? Justifier à l'aide des tableaux de données. (1 point)
3.5 : Pourquoi a-t-on ajouté du chlorure de sodium dans l'ampoule à décanter ? Justifier à l'aide des
tableaux de données. (1 point)
L'eugénol est insoluble dans l'eau salée et très soluble dans le dichlorométhane.
3.6
: Les deux autres solvants proposés dans les tableaux sont-ils
utilisables pour réaliser l'extraction ? Justifier à l'aide des
tableaux de données.
L'éthanol ne convient pas, il est miscible à l'eau.
Le cyclohexane convient : il n'est pas miscible à l'eau et l'eugénol est très soluble dans le cyclohexane.
3.7
: On réalise une chromatographie sur couche mince de l'huile
essentielle extraite des clous de girofle. On dépose sur la plaque, 2
extraits en solution dans le dichlorométhane et 2 produits de référence
dans le dichlorométhane. (9 points)

3.7-a : Donner le principe de la CCM. (3 points).
La
chromatographie permet de séparer et d'identifier les constituants d'un
mélange. Elle est basée sur la différence d'affinité d'un produit pour le solvant (l'éluant) et pour le support fixe solide.
Le révélateur ( KMnO4,
vapeurs de diiode) réagit chimiquement avec des produits incolores
fixés sur le support et les rend visibles ou encore l'action de la
lumière UV sur les composées aromatiques.
Préparation de la cuve : Verser l'éluant jusqu'à 1cm de hauteur environ au fond d'un grand bécher. Couvrir.
3.7-b : Qu’appelle t’on « front de solvant » (1 point).
Il s'agit de la distance parcourue par le solvant.
3.7-c : Quel le solvant le moins polaire de l’éluant ? Pourquoi ? (2 points)
Le toluène est peu polaire ( hydrocarbure) ; l'éthanol est polaire, il possède un atome d'oxygène électronégatif.
3.7-d : Donner la définition du rapport frontal (2 points)
Rf = distance parcourue par l'espèce X / distance parcourue par le solvant.
3.7-e : L'huile essentielle extraite des feuilles de giroflier contient-elle de l'éthanoate d'eugényle? Justifier.
Non . (F) ne présente pas de tache ayant le rapport frontal de l'éthanoate d'eugényle (A).
3.8 : Quelles sont les espèces chimiques pures identifiables contenues dans l'huile essentielle de clous de girofle ? (2 points)
(H)
: une tache a le même rapport frontal que l'eugénol commercial ( E)
etune autre tache a le même rapport frontal que l'éthanoate d'eugényle
( A).
|
|
|
|