Traitements
de la
thyroïde suite à un accident nucléaire. Concours général Stl 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Saturation
de
la thyroïde par l'iodure de potassium.
L’iode 131 est sans doute l’un des plus dangereux nucléides radioactifs
qui peuvent être rejetés dans l’atmosphère lors d’un incident
nucléaire. La fixation de l’iode 131 par la thyroïde peut mener à des
cancers de la thyroïde. En saturant celle-ci avec de l'iode non
radioactif, avant exposition, par ingestion de comprimés d’iodure de
potassium K127I, on observe une diminution de
l'absorption
d'iode radioactif d'un facteur supérieur ou égal à 90. Chaque comprimé
contient 130 mg d'iodure de potassium.
D’après
les informations données dans les documents, déterminer la période
(temps de demi-vie) de l’iode 131. Que pensez vous de l’affirmation
trouvée dans un des documents « au bout d’un an il n’en reste plus
trace dans les aliments ».
"la quantité d’iode-131 est divisée par 2 tous les 8 jours, par 2500
tous les trimestres et au bout d’un an il n’en reste plus trace dans
les aliments".
La demi-vie de l'iode 131 est de 8 jours.
1 an = 365 jours = 365/8 ~46 périodes. L'iode 131 résiduel au bout d'un
an est donc égale à la masse initiale divisée par 246
=7 1013.
L'affirmation est exacte.
On se propose de doser les ions iodure contenus dans un comprimé, de
façon à vérifier la qualité des comprimés dans une plaquette donnée.
Dans ce but, on effectue un dosage à l’aide d’une solution étalonnée de
nitrate d’argent.
L’iodure d’argent AgI est un solide ionique jaune très peu soluble dans
l’eau dont le produit de solubilité pKS vaut
16,2 à 25 °C.
Par dissolution de dix comprimés d’iodure de potassium préparé par la
Pharmacie Centrale des Armées dans un volume V0
= 1000 mL
d’eau, on obtient la solution S.
On dose les ions iodure contenus dans une prise d’essai E = 100 mL de
solution S à l’aide d’une solution de nitrate d’argent de concentration
CAg = 0,130 mol.L-1
placée dans une burette. On
effectue un suivi de la conductivité de la solution contenue dans le
bécher et on obtient la courbe représentée ci- dessous.
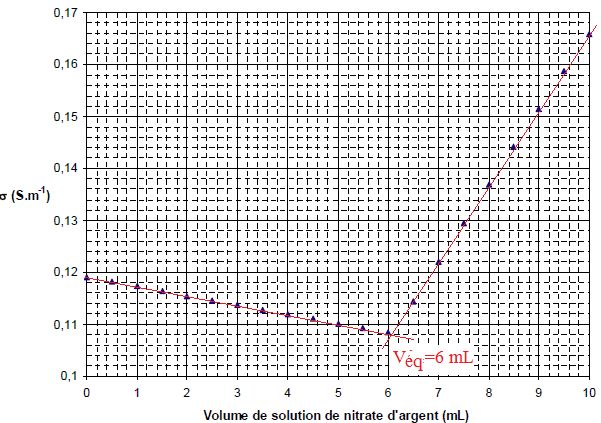
Écrire
l’équation de
la réaction support du titrage et déterminer la valeur de la constante
d’équilibre de cette réaction. Commenter.
Ag+aq + I-aq = AgI(s). K
= 1/[Ag+aq][I-aq] =
1/Ks =1016,2.
La constante d'équilibre étant très grande, la réaction est totale.
Justifier
qualitativement l’allure de la courbe et la position du point
d’équivalence.
Avant
l'équivalence les ions argent sont en défaut; du
point de
vue de la conductimétrie tout se passe comme si on remplaçait les ions
potassium par des ions nitrate. de conductivité molaire ionique un peu
plus faible : la conductivité de la solution décroït lentement.
Après
l'équivalence : exès d'ion argent ; de plus on apporte des
ion
nitrate : la conductivité croït rapidement.
En
déduire, à l’aide d’une démarche décrite précisément, la valeur de la
masse m d’iodure de potassium contenue dans un comprimé. Ce résultat
est-il conforme à l’inscription figurant sur la boîte ?
A l'équivalence : quantité de matière de KI : CAg
Véq
= 0,130*6 10-3 =7,8 10-4
mol.
m = 7,8
10-4 M(KI) = 7,8
10-4 *166 =0,129 g = 129 mg.
L'écart relatif avec l'indication de l'étiquette est inférieur à 1 %.
Ce résultat est conforme.
|
| ..
.. |
|
|
Étude
de la
L-thyroxine, hormone secrétée par la glande thyroïde.
La thyroxine, hormone secrétée par la glande thyroïde, a été isolée en
1910, à partir de trois tonnes de thyroïde de porc par Edward Calvin
Kendall, biochimiste américain qui reçut le prix Nobel de médecine en
1950. En 1930, Charles Robert Harington et Williams Thomas Salter,
chimistes britanniques, ont identifié la thyroxine naturelle à
l’isomère L.
La synthèse de la L-thyroxine, constituant principal du lévothyrox
utilisé comme traitement substitutif pour remplacer la thyroxine
naturelle lorsque celle-ci n'est plus sécrétée en quantité suffisante
par la thyroïde, a été réalisée à partir de la L-tyrosine en 1949.
La L-tyrosine est représentée ci-contre.
Que
signifie le « L » dans L-tyrosine ?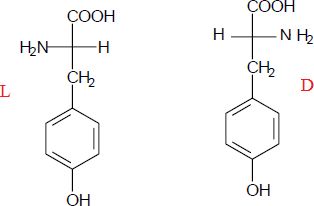
L signifie lévogyre.
Quelle
particularité possède ce composé ?
Ce composé est optiquement actif.
Représenter
la D-tyrosine.
Quelles
sont les analogies et les différences dans les propriétés physiques et
chimiques de la L-tyrosine et à la D-tyrosine.
Mêmes propriétés chimiques et physiques, à l'exception de l'action sur
la lumière polarisée.
|
.
|
|
Étude
de
quelques étapes de la synthèse chimique de la L-thyroxine.
La première étape de la synthèse chimique de la L-thyroxine consiste à
faire réagir la L-tyrosine avec un mélange sulfonitrique (mélange acide
sulfurique concentré – acide nitrique concentré) à 0 °C puis à traiter
le milieu réactionnel par de la soude (hydroxyde de sodium) jusqu’à un
pH voisin de 7. Après purification, on obtient un solide A dont la
formule semi-développée est donnée ci-dessous :
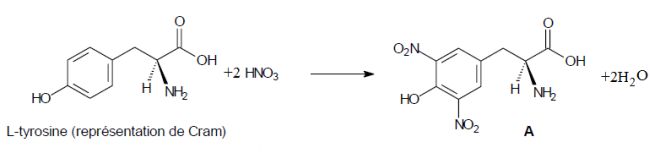
Préciser
la nature de cette réaction. Substitution électrophile sur
le
noyau benzénique.
Lors de cette réaction, l’entité réactive est l’ion nitronium NO2+.
Sachant que les numéros atomiques respectifs des éléments azote N et
oxygène O sont 7 et 8, établir
une
structure de Lewis de cet ion, indiquer sa géométrie et la représenter.
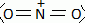 type AX2,
linéaire.
type AX2,
linéaire.
La deuxième étape de la synthèse consiste à faire réagir l’anhydride
acétique (anhydride éthanoïque) sur A. Après divers traitements, on
obtient B, représenté ci-dessous :
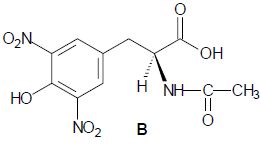
Donner
le nom de la nouvelle fonction créée. Fonction amide.
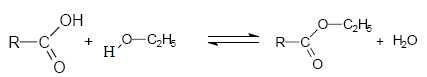
Lors de la troisième étape, on réalise l’estérification de B avec de
l’éthanol absolu (éthanol de pureté 100 %), en présence d’un acide
fort. Après extraction et purification, on obtient C, représenté
ci-dessous :
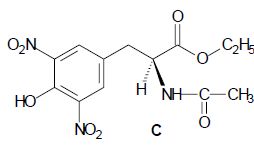
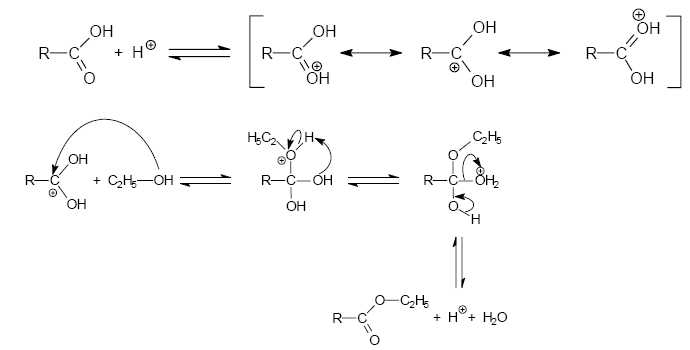
Un mécanisme de la réaction d’estérification est proposé. Pour
simplifier l’écriture de ce mécanisme, on pose :
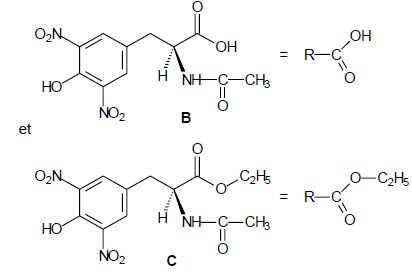
Ecrire
l’équation de la réaction d’estérification (on adoptera
les notations simplifiées données ci-dessus pour B et C).
Préciser
le rôle de l’acide fort et citer au moins deux composés chimiques
(formule et nom) permettant d’apporter dans le milieu réactionnel des
ions H+.
H+ joue le rôle de catalyseur ; il est apporté
par l'acide sulfurique H2SO4
ou l'acide phosphorique H3PO4.
Justifier
le fait que le carbone du groupe carboxyle (−COOH) est électrophile.
Pourquoi peut-on affirmer que ce caractère électrophile est renforcé en
milieu acide ?
L'atome d'oxygène est plus électronégatif que l'atome de carbone ; il
attire à lui les électrons de la liaison C=O. De ce fait le carbone est
déficitaire en électron.
Parmi les trois représentations proposées, on voit que le carbone du
groupe carboxyle porte une charge positive. Le caractère électrophile
de ce carbone est renforcé en milieu acide, l'atome d'oxygène étant
protoné.
|
|
|
Après
six autres étapes à partir de C, on obtient la L-thyroxine dont la
formule est représentée ci-dessous :
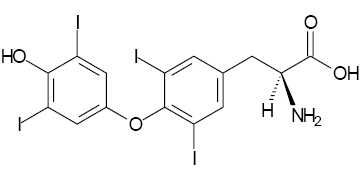
Quelle
particularité structurale, par rapport à la L-tyrosine, la L-thyroxine
synthétisée possède-elle ?
Dans les deux molécules, le carbone symétrique a la même configuration.
Le cycle benzénique de la L-tyrosine a été substitué par deux
atomes d'iode. Le groupe hydroxyle fixé sur le noyau
benzénique ( phénol ) est substitué. On remarque la présence
de trois atomes d'iode dans la L-thyrosine.
Le principe actif du lévothyrox® est la lévothyroxine sodique
représentée ci-dessous :
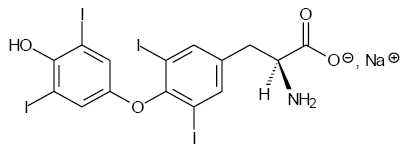
Proposer
une explication au fait que le lévothyrox soit administré sous cette
forme.
Cette forme sodique est ionique, donc soluble dans un solvant
polaire comme l'eau.
|
|
|