Identifier des
composés, synthèse paracétamol . Concours technicien fraudes 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Identification
de composés.
Par analyse
pondérale.
L'analyse pondérale du composé organique I ( CxHyOz) donne en
pourcentage C : 64,5 % et H : 10,7 %. Donner sa formule brute si sa
masse molaire est M = 130 g/mol.
12x /0,645 = 130 ; x =7 ; y / 0,107 =
130 ; y = 14 ;
% O = 100-64,5-10,7 =
24,8 % ; 16z / 0,248 = 130 soit z =2.
C7H14O2.
Par analyse
chimique.
Un alcool A de formule brute C4H10O est soumis à
une oxydation ménagée par action du dichromate de potassium en milieu
acide. Le dérivé organique B résultant donne un précipité jaune avec la
DNPH et est sans action sur la liqueur de Fehling. Identifier A et B.
Un alcool secondaire
conduit par oxydation ménagée à une cétone ( test positif avec la DNPH
et négatif avec la liqueur de Fehling).
On identifie A au
butan-2-ol H3C-CH OH-CH2-CH3
et B à la butanone H3C-CO-CH2-CH3.
Par analyse
spectrale :
Un composé a pour formule C6H6.
Le spectre IR présente deux pics principaux : l'un vers 2200 cm-1
et l'autre plus large vers 1650 cm-1. Prévoir les fonctions
probables.
Le pic vers 1650 cm-1
correspond à une double liaison C=C et le pic à 2200 cm-1 à
une triple liaison carbone carbone.
Le spectre RMN met en évidence deux type de protons
dans la molécule. Quelle est la formule semi-développée du composé ?
Nombre d'insaturations :
(2*6+2 -6) / 2 = 4. ( une liaison triple et deux liaisons doubles).

Réactions
chimiques.
Oxydation des ions iodure en diiode par l'eau oxygénée en milieu acide.
Couples H2O2/H2O et I2 / I-.
Ecrire les demi-équation et en déduire l'équation bilan.
Réduction : H2O2
+2e- +2H+=2H2O.
Oxydation : 2I -
= I2 + 2e-.
Bilan : H2O2 +2I - +2H+=2H2O+
I2 .
Ecrire l'équation de la réaction d'estérification permettant d'obtenir :
l'éthanoate de butyle
CH3COOH
+ HOCH2-CH2-CH2-CH3 = CH3COO-CH2-CH2-CH2-CH3
+H2O.
le benzoate de méthyle
C6H5-COOH
+ CH3OH = C6H5-COO-CH3 +H2O.
|
| .
. |
|
|
Les
équilibres chimiques.
La synthèse de l'ammoniac se fait par réaction du diazote sur le
dihydrogène. Cette réaction donne lieu à un équilibre chimique.
Ecrire l'équation bilan et exprimer sa constante d'équilibre.
N2(g) + 3H2(g) ---> 2NH3(g).
Pression partielle en diazote PN2 ; pression partielle en
dihydrogène PH2 ; pression partielle en ammoniac PNH3.
Constante d'équilibre K = P2NH3 / (PN2 P3H2).
Que
représente cette constante d'équilibre ? de quoi peut-elle dépendre ?
K ne dépend que de la température. K caractérise un état d'équilibre.
Comment peut-on déplacer l'équilibre dans un sens ou dans l'autre ?
A température constante,
une augmentation de pression déplace l'équilibre dans le sens direct (
diminution du nombre de molécules).
La réaction étant
exothermique dans le sens direct, est favorisée par une diminution de
température.
Un excès de l'un des
réactifs déplace l'équilibre dans le sens direct.
|
.
|
|
Synthèse
du paracétamol.
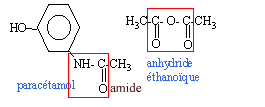
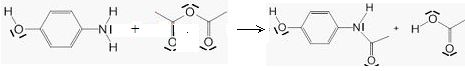
On l'obtient par réaction du para-aminophénol et d'anhydride éthanoïque
en milieu aqueux. Ecrire la formule semi-développée de l'anhydride
éthanoïque et entourer le groupe anhydride. Ecrire la formule semi-développée du
paracétamol et entourer le groupe amide.
Justifier l'état physique
du para-aminophénol versé dans le ballon tricol.
Température de fusion : 187 °C,
ce réactif est donc solide.
Justifier l'apparition du précipité de paracétamol lors du
refroidissement au bain de glace.
La solubilité du
paracétamol dans l'eau est très faible ( 1 g dans 100 g à 20°C et
encore moindre à 0°C).
Ecrire l'équation bilan de la réaction.
Calculer les quantités de matière initiales des réactifs. Quel est le
réactif limitant ?
m = 10,0 g de para-aminophénol soit n1=
m / M(para-aminophénol) = 10,0 / 109 =9,17 10-2
mol.
V =12 mL d'anhydride
éthanoïque soit en masse : volume fois masse volumique = 12*1,082
=12,98 g
n2
= 12,98 / M( anhydride) = 12,98 / 102 =0,127 mol.
La réaction se faisant
mol à mol l'anhydride est en excès et le para-aminophénol en défaut.
Calculer la quantité de
matière théorique nth de paracétamol suceptible d'être
obtenue et en déduire le rendement de la synthèse.
nth = n1 = 9,17 10-2
mol.
Masse de produit obtenu : 10,8 g ; quantité de matière correspondante :
nexp =10,8 / M(paracétamol) = 10,8 /151 = 7,15 10-2
mol.
Rendement =nexp / nth= 7,15 /
9,17 ~0,78 ( 78 %).
|
|