Chimie organique :
concours Atpl2 Nice 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Sécurité.

1 : protection obligatoire des voies respiratoires ; : rinçage des yeux ;
3 : premiers secours ; 4 : protection obligatoire des mains
Citer deux EPI (équipements de
protection individuels) obligatoires en salle de travaux pratiques et
deux EPC (équipements de protection collective).
EPI : blouse,lunette de sécurité, gants.
EPC : Extincteur, Postes
de sécurité microbiologiques.
Sorbonnes pour la protection contre le
risque chimique, pour les produits volatils toxiques par inhalation ; ventilation correcte des locaux.
Conteneurs adaptés
pour les produits souillés.
Stockage
réglementaire des produits dangereux.
Ecriture
chimique.
Quelle est la formule moléculaire du méthane ?
C4H10 (faux ) ;
C3H8 (faux) ; CH4
(vrai ) ; CO2
(faux).
Quels sont les coefficients manquant pour que ces équations soient
équilibrées ?
C2H5OH
+ 3 O2
---> 2CO2
+ 3
H2O
Quelle est la formule moléculaire du diazote ?
N2 (vrai)
; AZ2 (faux) ; A2 ( faux)
; H2 ( faux).
Quelle est la formule moléculaire du dioxyde de carbone ?
CO (faux) ; CO2 (vrai) ; C2O
(faux) ; C2O2(faux).
Donner la formule semi - développée des molécules suivantes.
2,2-diméthylbutane :H3C-C(CH3)2-CH2-CH3.
triméthylamine : N(CH3)3.
3-méthyl-2-propylhexanal : H3C-CH2-CH2-CH(CH3)-CH(CH2-CH2-CH3)-CHO.
|
| .
. |
|
|
Fonctions
chimiques.
Pour le composé suivant :
donner la formule brute et nommer les fonctions présentes en entourant
le ou les groupes fonctionnels.
Vérifier si les
nombres d’insaturations calculés se retrouvent sur les formules
structurales.
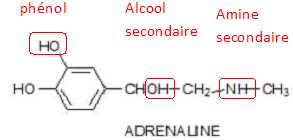
C9H13O3N.
Nombre d'insaturations : (9*2+2+1-13 ) / 2 = 4.( cycle aromatique ).
A partir du
calcul de degré d’insaturation des formules suivantes, vérifier
qu’elles existent.
C10H12O2
:
nombre d'insaturations : (10*2+2 -12) / 2 =5.
C10H21Br2Cl2N
:
nombre
d'insaturations : (10*2+2 +1-4-21) / 2 =-1. Impossible.
|
.
|
|
1,367
g d’un composé organique de formule CxHyOz ont été brûlés dans un excès
d’air et ont donné 3,002 g de dioxyde de carbone et 1,640 g d’eau.
Quelle est la formule brute de ce composé ?
Masse molaire de ce composé M = 12 x +y+16 z.
CxHyOz +(x+0,25y-z)O2 ---> xCO2 +0,5 yH2O.
Quantité de matière de CO2 : n =3,002 / 44 =0,0682 mol ; masse de carbone correspondante : 12*0,0682 =0,8187 g
Pourcentage de carbone : 0,8187 / 1,367 *100 =59,9 %.
Quantité de matière de H2O : n' =1,640 / 18 =0,0911 mol ; masse d'élément hydrogène correspondante : 2*0,0911 =0,1822 g
Pourcentage d'élément hydrogène : 0,1822 / 1,367 *100 =13,3 %
Pourcentage d'élément oxygène :100 -59,9-13,3 =26,8 %.
12 x / 0,599 = y / 0133 = 16z / 0,268.
Les deux premiers rapports donnent : x =0,375 y.
Les deux derniers rapports donnent : y =7,94 z ~8 z.
Par suite : x ~3 z.
x, y et z sont entiers ; par suite (C3H8O) n avec n entier.
|
|
|