Calorimétrie,
électricité, chimie :
concours Atpl2 Nice 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Calorimétrie.
Un calorimètre contient 100 g d’eau à 18°C, on y verse 80 g d’eau à
90°C.
Déterminer la température d’équilibre si on néglige la capacité
thermique du calorimètre et de ses
accessoires.
Energie gagnée par l'eau
froide : Q1 = m1 ceau ( qéqui-q1)
;
Energie cédée par l'eau chaude : Q2 =
m2 ceau ( qéqui-q2) ;
Système adiabatique : Q1 +Q2 =0 ; m1 ceau ( qéqui-q1) +m2 ceau
( qéqui-q2) =0
(m1 +m2)qéqui = m1q1 + m2q2 ; qéqui =(m1q1
+ m2q2)/(m1 +m2) ;
qéqui
= 100*18 +80*90) / 180 = 50 °C.
La température d’équilibre
est en fait 35,9 °C, en déduire la capacité thermique du calorimètre et
de
ses accessoires. On donne : ceau = 4180 J.kg-1.K-1.
Energie gagnée par l'eau froide et le
calorimètre : Q1 = (m1 ceau
+µ)( qéqui-q1)
;
Energie cédée par l'eau chaude : Q2 =
m2 ceau ( qéqui-q2) ;
Système adiabatique : Q1 +Q2 =0 ;
(m1 ceau
+µ)( qéqui-q1)+m2
ceau ( qéqui-q2) =0 ;
m1 ceau +µ = m2 ceau ( qéqui-q2) / (q1-qéqui)
µ = m2 ceau ( qéqui-q2) / (q1-qéqui) -m1 ceau ;
µ =0,080*4180(35,9-90) / (18-35,9) -0,100*4180 ~593 J.kg-1.K-1.
Electricité.
Placer sur le schéma
un ampèremètre pour mesurer i1. Placer sur le schéma un
voltmètre pour mesurer U2.
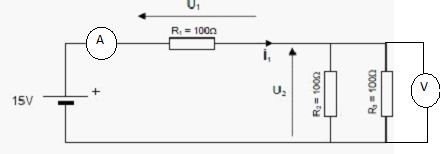
Donner
les valeurs de U2, U1 et I1.
Les deux résistances en
dérivation sont équivalente à R =50 ohms ; la résistance équivalente du
circuit est équivalente à 100+50 = 150 ohms ; I1 = 15 / 150
= 0,10 ampère.
U1 = 100*0,10 = 10 V et U2
= 50 *0,10 = 5 V.
Pour réaliser le montage nous
avons le choix entre plusieurs résistances de différentes puissances.
Cocher la case correspondant à la résistance dont la puissance dissipée
est la mieux adaptée.
Puissance consommée dans R1
: U1I1= 10*0,1 = 1 W ;
puissance consommée dans R2 ou R3 : U2I2= 5*0,05 = 0,25 W ;
Choix
|
100
ohm ; 0,25 W
|
100 ohm
; 0,5 W |
100 ohm
; 1 W |
100 ohm
; 2 W |
100 ohm ; 5 W |
R1
|
|
|
X
|
|
|
R2
|
X
|
|
|
|
|
R3
|
X
|
|
|
|
|
Compléter le tableau suivant :
Grandeur
|
tension
|
intensité
|
Puissance
|
Résistance
électrique
|
capacité
|
inductance
|
induction
magnétique
|
Quantité
d'électricité
|
Flux
magnétique
|
U
|
I
|
P
|
R
|
C
|
L
|
B
|
Q
|
F
|
Unité
|
volt
|
ampère
|
watt
|
ohm
|
farad
|
henry
|
tesla
|
coulomb
|
weber
|
V
|
A
|
W
|
W
|
F
|
H
|
T
|
C
|
Wb
|
.
|
| .
. |
|
|
Représenter
sur le schéma ci-dessus les branchements à réaliser pour observer les
tensions Ugbf et UR avec un oscilloscope.
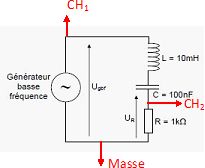
On observe à l’oscilloscope les signaux Ugbf et UR.
Ces deux signaux sont représentés ci-dessous.
Ugbf sur CH1 et UR sur CH2.
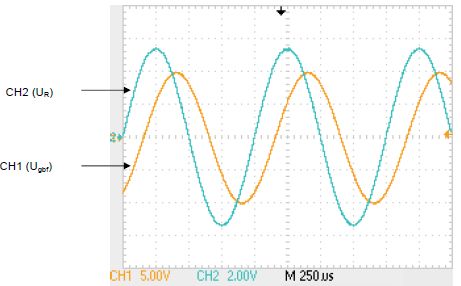
Quelle
est l’amplitude des signaux Ugbf et UR ? Ugbf
max = 10 V ; UR max ~4,6 V.
Quelle est la valeur efficace des signaux Ugbf et UR
?
Ugbf
eff = 10 /1,414 ~7,1 V ; UR eff ~4,6 /1,414 ~3,3 V.
Quelle est la
valeur moyenne des signaux Ugbf et UR ?
La valeur moyenne d'un
signal sinusoïdal est nulle.
Quelle est la fréquence des signaux Ugbf et UR ?
T = 4 *250 = 1000 µs =
1,0 10-3 s ; f = 1/T = 1,0 103
Hz.
Quelle est le déphasage du signal UR par rapport au signal Ugbf
?
UR
est en avance de 0,6*250 = 150 µs ou 0,6 / 4 =0,15 période ou 6,28*0,15
=0,94 radian.
A quelle fréquence doit on régler le générateur pour obtenir une
amplitude de UR maximum ?
f = 1/(2p(LC)½) =1/(6,28(0,010*10-7)½)~5,0
kHz.
A cette fréquence que vaut le déphasage entre Ugbf et UR
?
Ces deux signaux sont en
phase.
|
.
|
|
Réactions acidobasiques. On se placera dans les conditions standards de pression et de température.
Quelles sont les valeurs de C(H30+) et de C(OH-) dans l'eau pure ? 10-7 mol/L.
Quelle est la valeur de Ke pour toute solution aqueuse diluée ? 10-14 .
Que vaut C(H30+) dans une solution dans laquelle C(OH-) vaut 10-4 mol·L-1 ? Ke / C(OH-) = 10-10 mol/L.
Quel est le pH d'une solution de H2SO4 à 6.10-3 mol·L-1 ?
L'acide sulfurique est un diacide fort : C(H30+) =2*6 10-3 = 1,2 10-2 mol/L ; pH = - log(1,2 10-2 ) =1,9.
Quel est le pH d'une solution de NaOH à 0,0001 mol·L-1 ?
La soude est une base forte : pH = 14 + log c = 14 + log 0,0001 = 10.
Un jus de citron a un pH = 2,3. Calculer les concentrations en ions hydronium et hydroxyde.
C(H30+) = 10-pH = 10-2,3 =5,0 10-3 mol/L et C(OH-) = Ke /C(H30+) = 2,0 10-12 mol/L.
Atomistique.
Quel est le nombre de neutrons, de protons et d’électrons présents dans chacun des atomes ou des ions suivants :
199F : 9 protons; 9 électrons et 19-9 = 10 neutrons.
5224Cr3+ : 24 protons ; 52-24 =28 neutrons et 21 électrons.
12753I- : 53 protons ; 127-53 =74 neutrons et 54 électrons.
7934Se2- : 34 protons ; 79-34 =45 neutrons et 36 électrons.
Quel atome a pour configuration électronique fondamentale 1s2 2s2 2p6 ? Néon.
Quel cation de charge +2 possède la même configuration électronique 1s2 2s2 2p6 ? Mg2+.
Quel anion de charge -1 possède la même configuration électronique 1s2 2s2 2p6 ? F-.
Quelle est la taille approximative d’un atome ? 10 -10 m.
Dissolution de composés chimiques.
Compléter les phrases en utilisant le vocabulaire approprié parmi les propositions données ci-dessous ::
dissoudre - dissolution - dissous - solution - soluble - solvant - soluté – saturée
Le sucre est très facile à dissoudre dans l'eau.
Le mélange obtenu est une solution d'eau sucrée.
L'eau, capable de dissoudre le sucre, est le solvant.
Le sucre qui se fait dissoudre, est le soluté.
L'action de dissoudre le sucre dans l'eau est une dissolution.
Comme le sucre, le sel est aussi une substance très soluble dans l'eau.
|
|
|
Oxydoréduction.
Pour
le soudage des rails sur les voies ferrées, les employés de la SNCF
utilisent une réaction d’aluminothermie. Les réactifs sont l’aluminium
et l’oxyde de fer III contenant des ions Fe3+.
On donne les masses molaires atomiques : M(Fe) = 56 g/mol, M(Al) = 27 g/mol, M(O) = 32g/mol.
Quels sont les deux couples oxydant - réducteur intervenant dans cette réaction ?
Al2O3 / Al et Fe2O3 / Fe.
Quel est le corps oxydé ? aluminium.
Quel est le corps réduit ? Fe2O3 .
Ecrire les 2 demi-équations bilan de l’oxydo réduction.
2Al + 3H2O = Al2O3 +6H+ + 6e-.
Fe2O3 +6H+ + 6e- = 2Fe + 3H2O.
Ecrire l’équation globale de la réaction d’aluminothermie.
2Al + Fe2O3 = Al2O3 +2Fe.
Quelle masse d’aluminium faut-il faire réagir pour produire 0,28 kg de fer ?
n(Fe) =m(Fe) / M(Fe)=280/ 56 =5 mol ; n(Al) = n(Fe) = 5 mol ; m(Al) =n(Al) M(Al) = 5*27 =135 g~0,14 kg.
|
|
|