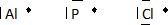Les propriétés de
l'aluminium : atomistique, cristallographie, isotopes, électrolyse,
solubilité Al(OH)3. Concours Assistant d'ingénieur Maine
Itrf 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Atomistique.
Données : Z(Al) = 13 ; Z(P) = 15; Z(Cl) = 17
Etablir la configuration électronique et le schéma de Lewis des
atomes d’aluminium, de chlore et de phosphore.
Al : 1s2
2s2 2p6 3s2 3p1 ; P : Al : 1s2 2s2 2p6
3s2 3p3 ; Cl :Al : 1s2
2s2 2p6 3s2 3p5.
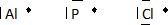
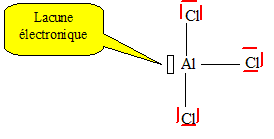
Etablir le schéma de Lewis des édifices AlCl3
et PCl3. On précisera sur chaque molécule l’éventuelle
présence d’électrons célibataires, de doublets non-liants ou de lacunes
électroniques.
Quelle est la géométrie de AlCl3 et de PCl3
(donner son nom, la représenter et donner la valeur des angles).
PCl3
: pyramide à base triangulaire, angle 100° ; AlCl3
: plane, angle 120°.
Quelle propriété possède
AlCl3. Justifier. Citer une application de son utilisation
Du fait de la lacune
électronique, AlCl3 est un acide de Lewis, accepteur de doublet électronique,
catalyseur dans la réaction de Friedel et Crafts.
Cristallographie.
A température ambiante, l’aluminium a une structure cubique à face
centrée. L’atome d’aluminium est supposé sphérique. On donne le nombre
d’Avogadro NA = 6,02.1023, la masse molaire de
l’aluminium M = 27,0 g.mol-1 et la masse volumique de
l’aluminium μ = 2,70 g.cm-3.
Représenter la maille conventionnelle. Combien d’atomes contient
cette maille ? Quelle est la coordinence de chaque atome (justifier) ?
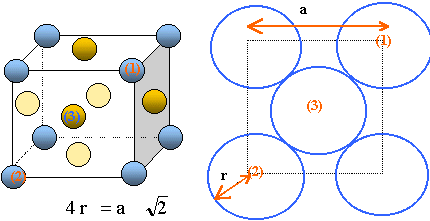
Chaque
atome situé sur un sommet appartient à huit mailles et contribue pour 1
/8 éme à la maille.Chaque atome situé au centre d'une face appartient à
deux mailles et contribue pour ½ à la maille.il y a donc 3+1 = 4 atomes par maille.
La coordinence ou nombre t'atomes en contact avec une sphère, est égale
à 12.
Quel
autre empilement possède la même coordinence ?
La structure
hexagonale compact.
Déterminer le paramètre de la maille conventionnelle.
Volume de la maille V=a3
;
masse de la maille :
m=4*M / NA =4*0,0270 / ( 6,02.1023) =1,794 10-25
kg.
µ =m/V = m / a3 ; a =(m / µ)1/3= (1,794 10-25
/2700)1/3=4,05 10-10 m.
|
| .
. |
|
|
Isotopes.
L’isotope 26 est instable contrairement à
l’isotope 27. Donner la composition de son noyau en nucléons.13 protons et 26-13 = 13 neutrons.
L’isotope 26 est radioactif ß+. Ecrire l’équation de
sa désintégration. On nommera X le produit de la désintégration et on
nommera les autres particules créées.
2613Al ---> 2612Mg*
+01e( positon) puis 2612Mg* ---> 2612Mg + g.
La demi-vie de cet isotope vaut T = 7,17.105 ans. Il est utilisé pour dater la formation des
premiers solides du système solaire. Donner la loi de décroissance
radioactive. Définir les termes entrant dans la formule.
N = N0
exp(-lt).
N : nombre de noyaux
présents à la date t ; N0 : nombre de noyaux initiaux ; l constante radioactive en s-1;
t : temps en seconde.
Lors de sa création, 10 % des atomes d’un échantillon d’aluminium
étaient de l’aluminium 26. L’échantillon contient maintenant 0,001 %
d’aluminium 26. Quel est l’âge de l’échantillon ?
ln (N0
/ N ) = l t = ln 2 t / T ; t = T ln (N0 / N ) / ln 2 =7,17.105
ln(10/0,001) / ln2 =9,5 106 ans.
|
.
|
|
Electrolyse
d’une solution d’ions aluminium.
On souhaite tracer la courbe voltampérométrique (courbe intensité -
potentiel) d’une solution acidifiée (pH = 1) de chlorure d’aluminium
telle que [Al3+] = 0,1 mol.L-1. On utilise le
montage classique à 3 électrodes. L’électrode de travail est en
aluminium décapé préalablement. L’électrode de référence est au calomel
saturé (ECS) dont le potentiel sera pris égal à 0,24 V par rapport à
l’électrode standard à hydrogène (ESH) à la température considérée
(25°C). La pression des gaz sera prise égale à 1 bar.
Quel matériau choisissez-vous pour l’électrode auxiliaire ? Faire un
schéma annoté de l’ECS. Que vérifiez-vous pour vous assurer que l’ECS
est en état de fonctionnement ? Pourquoi a-t-on tendance à ne plus
employer cette électrode ? Par quoi suggérez-vous de la remplacer ?
L'électrode auxiliaire est en platine.
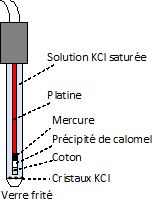
Il faut controler visuellement la présence de cristaux de KCl, c'est à
dire veiller à une saturation effective de la solution de remplissage
de l'électrode.
L'électrode au chlorure d'argent ( argent / chlorure d'argent / KCl
saturé + AgCl saturé) est simple dans sa constitution, peu encombrante
: elle remplace ECS.
Schématiser le montage expérimental. Pour cela, on placera : les 3
électrodes, le vase à réaction, un générateur, un ampèremètre et un
voltmètre.
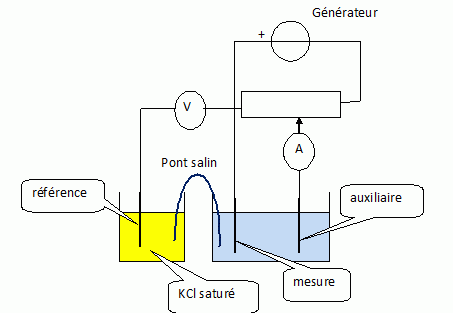
On a représenté
ci-dessous les courbes théoriques correspondant aux couples mis en jeu.
La température est égale à 25°C.
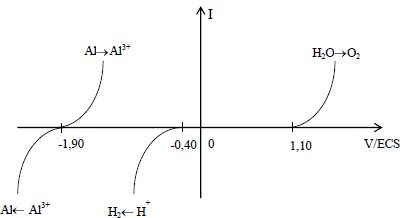
Indiquer sur le graphe quelles courbes correspondent à une oxydation
(O) ou à une réduction (R).
Oxydation : Al ---> Al3+ ; H2O ---> O2.
Réduction : Al3+ ---> Al ; H+ ---> H2.
Le couple Al3+ / Al est-il rapide ? (justifier) Calculer son
potentiel standard à partir d’une lecture sur la courbe et des données.
Pour un système rapide la surtension s'annule lorsque l'intensité
s'annule : le couple Al3+ / Al est rapide.
-1,90 +0,24 = -1,66 V.
Rappeler la valeur du potentiel standard du couple H+ / H2.
Déterminer si le couple H+ / H2 est rapide sur
électrode d’aluminium à partir de la courbe et des données. Calculer
son éventuelle surtension sur électrode d’aluminium.
E(H+ / H2) = 0 V ; le graphe indique une surtension
égale à 1,10 +0,40 = 1,5 V lorsque l'intensité s'annule. Ce couple est
lent.
A partir des courbes théoriques précédentes, prévoir s’il est possible
de déposer de l’aluminium métallique sur l’électrode d’aluminium dans
les conditions expérimentales proposées. De même, prédire s’il est
possible de dissoudre l’électrode d’aluminium. Justifier.
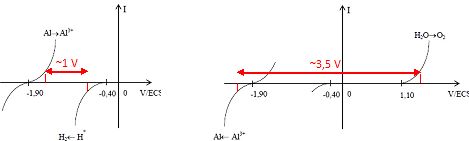
L'intensité traversant les électrodes est la même en valeur absolue.
Pour une ddp de l'ordre de 1 V et une anode en aluminium positive
on observe l'oxydation de l'aluminium et la réduction de H+
; pour une ddp de l'ordre de 3,5 V, et une cathode en aluminium
négative, on observe la réduction de Al3+ et l'oxydation de
l'eau.
|
|
|
Solubilité de
l’hydroxyde d’aluminium.
Le pKs de l’hydoxyde d’aluminium vaut 33,5. On néglige
arbitrairement l’autoprotolyse de l’eau.
Déterminer puis calculer la solubilité s de l’hydroxyde d’aluminium
dans l’eau pure en mol.L-1.
Al(OH)3
s =Al3++3HO-
(1) ; Ks
= [Al3+][HO-]3.
La
solution est électriquement neutre : 3[Al3+] = [HO-] ; Ks = 27 [Al3+]4
= 10-33,5 ; [Al3+] =1,85 10-9 mol/L.
De même, déterminer puis calculer la solubilité s’ de l’hydroxyde
d’aluminium dans une solution dont le pH initial vaut 13. Les
éventuelles hypothèses et approximations dans le calcul seront
justifiées.
[HO-] = 0,1 mol/L ; [Al3+] = 10-33,5 / 10-3
= 10-30,5 mol/L.
Quel effet permet
d’expliquer l’évolution entre s et s’.
effet
d'ion commun : la soude apporte des ions hydroxyde à la
solution ; l'équilibre (1) est déplacé en sens indirect, vers la
gauche. Ks ne dépend que de la température et à température
constante la solubilité de Al3+ va donc diminuer.
On souhaite maintenant vérifier la
concentration de la soude de pH = 13 utilisée dans l’expérience
précédente. Cette solution a été préparée il y a une semaine à partir
de pastilles de soude.
Pourquoi vouloir étalonner cette solution ? (2 raisons).
Les pastilles de soude
absorbent de l'eau il n'est
pas toujours possible de peser la masse exacte nécessaire.
La soude se carbonate (
en présence du CO2 de l'air) au cours du temps.
On étalonne la solution avec de l’acide oxalique H2C2O4,
2H2O par la méthode de l’étalon pesé. Les pKa de
l’acide oxalique valent respectivement 1,2 et 4,3. Sa masse molaire
vaut M = 126,1 g. mol-1. Zones de virage : Hélianthine
3,1 – 4,4 ; bleu de bromothymol 6,0 - 7,6 ; phénolphtaléine 8,2 - 10,0.
Faire un schéma de l’expérience. Quelle équivalence cherchez-vous à
détecter ? Quel(s) indicateur(s) peut-on utiliser ? (Justifier sans
faire de calcul).
Une masse d'acide
oxalique solide, pesée avec précision, est dissoute directement dans le
becher réactionnel puis est dosée par le réactif, la soude, à étalonner.
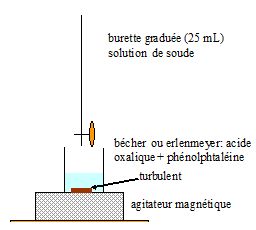
Le pH à l'équivalence
doit appartenir à la zone de virage de l'indicateur coloré. A l'équivalence, la solution contient une
base faible, l'ion oxalate : le pH est supérieur à 7. La phénolphtaléine convient.
On effectue plusieurs dosages qui conduisent aux résultats suivants :
Masse
pesée (g)
|
0,1261
|
0,129
|
0,1259
|
0,1252
|
0,1226
|
mmoy=0,1258
|
Volume
équivalent (mL)
|
20,05
|
20,50
|
20,05
|
19,95
|
19,50
|
V
moy =20,01
|
Déterminer le titre de la solution de
soude ainsi que son incertitude avec un intervalle de confiance de 95 %.
Dm = 0,1 mg ; DV = 0,02 mL.
H2C2O4
+ 2HO- = C2O42- + 2H2O.
n(soude) = 2n(acide oxalique).
Quantité de matière
d'acide oxalique n = mmoy / M =0,1258 / 126,1 =9,976 10-4
mol.
Quantité de matière de
soude : C Vmoy =20,01 10-3
C.
C = 2mmoy / (MVmoy
) = 2*9,976 10-4
/(20,01 10-3)=9,971
10-2 mol/L.
(DC/C)2 =(Dm/m)2 +(DV/V)2 =(0,1 / 125,8)2
+(0,02 / 20,01)2 =1,6 10-6 ; DC/C ~1,3 10-3 ; DC =1,3 10-4
~ 0,01 10-2 mol/L.
C = (9,97 ± 0,01 )10-2
mol/L.
|
|
|