Conductimérie :
mesure de la
salinité d'une eau osmosée. Concours Caplp maths sciences 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Ions
chlorure et ion sulfate.
On
souhaite dans un premier temps mettre en évidence la présence ou
l'absence d'ions chlorure et sulfate dans l'eau filtrée par l'osmoseur.
1.1 Lister les
moyens dont dispose le skipper pour obtenir de l'eau douce.
La quantité d'eau douce
embarquée étant limitée, le skipper utilise un dessalinisateur d'eau de
mer et récupère l'eau de pluie.
1. 2 Indiquer le
rôle de l'osmoseur sur le bateau.
L'osmoseur permet
d'obtenir de l'eau douce à partir de l'eau de mer.
1.3 Quelle salinité
ne doit pas dépasser l'eau pour être déclarée potable ?.
L'eau est déclarée
potable si la salinité est inférieure à 0,5 g/L.
1.4 Préciser
les mesures à réaliser pour vérifier la salinité de l'eau.
La salinité pouvant se
déduire de la mesure de la concentration massique Cm
des ions chlorure ( S(g/L) = 1,8 Cm
), il suffit de titrer les ions chlorure.
On dispose de deux échantillons d'eau : échantillon A : eau de mer
avant passage dans l'osmoseur ; échantillon B : eau de mer après son
passage dans l'osmoseur.
Capacités
mises en oeuvre : lire et
exploiter des informations.
2.1 Quels tests
d'itentification mettent en évidence la présence d'ion
chlorure et d'ion sulfate ?
En présence de nitrate
d'argent, les ions chlorure donnent un précipité blanc de chlorure
d'argent qui noirçit à la lumière. En présence de chlorure de baryum,
les ions sulfate donnent un précipité blanc de sulfate de baryum.
2.2 Proposer un
expérience simple permettant de mettre en évidence les ions
chlorure et sulfate dans l'eau filtrée par l'osmoseur.
Dans deux tubes à essais,
verser 2 mL d'eau filtrée par l'osmoseur. Dans le premier ajouter
quelques gouttes de solution de nitrate d'argent ; dans le second
ajouter quelques gouttes de chlorure de baryum. Si le test est positif, on observe un
précipité blanc.
2.3 Indiquer les
précautions à prendre pour manipuler ces solutions.
Nitrate d'argent :
corrosion cutanée et lésions oculaires graves
Chlorure de baryum :
toxicité aiguë par voie orale et par inhalation.
Port de lunette et gants,
travail sous hotte.
2.4 Calculer la
concentration massique des ions chlorures dans le cas d'une
eau de salinité S = 0,5 g/L.
Cm(Cl-)
= S / 1,8 = 0,5 / 1,8 = 0,277 ~0,3 g/L.
2.5 Vérifier par le
calcul que la concentration molaire en ions chlorures
est C = 0,01 mol/L.
C = Cm(Cl-)
/ M(Cl) =0,277 / 35,5 = 0,0078 ~0,01 mol/L.
Capacités mises en
oeuvre : Identifier des ions
en solution ; réaliser une
manipulation ; déterminer la concentration molaire ou massique.
|
| .
. |
|
|
Dosage des ions
chlorures.
3.1 Compléter
le dispositif expérimental.
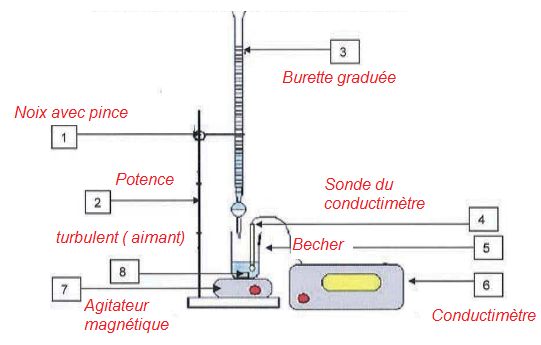
3.2 On prélève V0
= 20,0 mL d'eau filtrée. Quel matériel
utilise-t-on ?
Un
volume précis est prélevé à l'aide d'une pipette jaugée de 20,0 mL
surmontée d'un pipeteur.
Capacités mises en
oeuvre : réaliser une
manipulation ;
L'équation bilan de ce dosage est : Ag+ +
Cl- ---> AgCl(s).
4.1 Comment
déterminer graphiquement le volume équivalent VE.
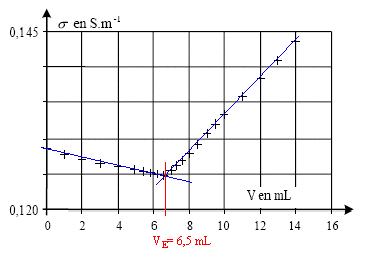
Le volume équivalent
correspond à l'abscisse de l'intersection des deux segments de droite.
4.2 Calculer n( Ag+)
si la concentration en nitrate d'argent est égale à C = 0,025
mol/L.
n( Ag+)
= C VE =0,025 * 6,5 = 0,1625 mmol.
4,3
En déduire la concentration molaire C0 en ion chlorure et
conclure.
C0
= n(Cl-) / V0
= n(Ag+) / V0
= 0,1625 / 20,0 =0,0081 mol/L soit 0,0081*35,5 ~0,29 g/L . L'eau
filtrée
est potable.
|
|
|
Un élève écrit sur son
compte-rendu qu'il a mesuré la conductance. Que pensez-vous de son
affirmation ? Argumenter.
Conductance
et conductivité sont proportionnelles ; la constante de proportionalité
est une caractéristique de la cellule de mesure.
Cela ne change rien quant à la détermination du volume équivalent.
Un
conductimètre est un appareil alimenté en courant alternatif de
fréquence variable ( entre 50 et 40 000 Hz) et relié à une cellule
conductimétrique. Expliquer les raisons de ce type d'alimentation
électrique et préciser la constitution de la cellule conductimétrique.
La polarisation des
électrodes est rendue négligeable par l'utilisation d'une tension
alternative de valeur
efficace inférieure à 0,25 V.
La
cellule conductimétrique est constituée de deux plaques rectangulaires
de platine platinés, de surface S, parallèles à une distance l sur un
support en verre. On mesure la résistance R ( ohm) du volume de liquide
délimité par les plaques ; la cellule indique la conductance G = 1/R (
siemens ).
Le
fabricants fournit une table de la conductivité d’une solution de
chlorure de potassium à 0,1 mol /L pour toutes les températures allant
de 15,0 à 30,0°C.
On mesure alors la conductance de cette solution de chlorure de
potassium et la température de la solution.
Les conductimétres sont munis d’un potentiométre d’étalonnage qui
permet d’ajuster la valeur lue à la valeur donnée par la table du
fabricant.
Est-il nécessaire d'estimer la valeur de la constante de cellule pour ce type de dosage ?
Non, afin de déterminer le
volume équivalent, on recherche l'intersection de deux droites.
Interpréter les variations de la conductivité observées avant et après l'équivalence.
Avant l'équivalence :
L'ion argent est en défaut ;
l'ion chlorure est en excès ; les ions nitrate et
sodium sont spectateurs. ( les ions oxonium et hydroxyde
sont minoritaires)
s = lNa+[Na+]
+ lCl-[Cl-]
+ lNO3-[NO3-].
On ajoute x = CV mol d'ion argent ( qui demeure en
défaut ) et x = CV mol d'ion nitrate.
x mol d'ion chlorure disparaissent : du point de vue de
la conductivité, tout se passe comme si on
remplaçait l'ion chlorure par l'ion nitrate.
Or lCl-
> lNO3- donc
la conductivité de la solution diminue.
On note V0 le volume de la solution dans le
becher et V le volume de nitrate d'argent ajouté
à la burette.
On note C la concentration du nitrate d'argent et
CS celle du chlorure de sodium.
[Na+] =V0 CS /
(V0+V) ; [Cl-] =(V0
CS -C V)/ (V0+V) ;
[NO3-] =CV/
(V0+V)
s = [lNa+V0
CS + lCl-(V0
CS -C V)+lNO3-CV]/
(V0+V)
s = [(lNa+
+ lCl-)
V0 CS + ( lNO3-
-lCl-)CV]/
(V0+V)
s (V0+V) =
(lNa+
+ lCl-)
V0 CS + ( lNO3-
-lCl-)CV.
|
|
Après l'équivalence :
L'ion chlorure est en défaut
; l'ion argent est en excès ; les ions nitrate et
sodium sont spectateurs. ( les ions oxonium et hydroxyde
sont minoritaires)
s = lNa+[Na+]
+ lAg+[Ag+]
+ lNO3-[NO3-]
on ajoute x = CV mol d'ion argent ( qui est en
excès de C(V-VE) ) et x = CV mol d'ion
nitrate.
L'ajout d'ions en solution se traduit par une
augmentation de la conductivité de la solution.
[Na+] =V0 CS /
(V0+V) ; [Ag+]
=C(V-VE)/ (V0+V) ;
[NO3-] =CV/
(V0+V)
s = [lNa+V0
CS + lAg+C(V-VE)+
lNO3-CV]/
(V0+V)
s = [lNa+V0
CS - lAg+C
VE + (
lNO3-
+lAg+)CV]/
(V0+V) ; or V0 CS = C
VE
s (V0+V) =
(lNa+
- lAg+
) VE C
+ (
lNO3-
+lAg+)CV
On trace s (V0+V) =
f(V) :
|
|
|