Analyse de la
composition chimique des météorites.
Concours Capes 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Certaines
météorites sont riches en carbone et contiennent des molécules
organiques susceptibles d'avoir joué un rôle dans l'apparition de la
vie sur Terre. Une extraction d'échantillons de météorites à l'acide
méthanoïque a mis en évidence en 2011 des nucléobases peu courantes sur
Terre et en particulier la 6,8-diaminopurine. On s'intéresse à sa
synthèse.
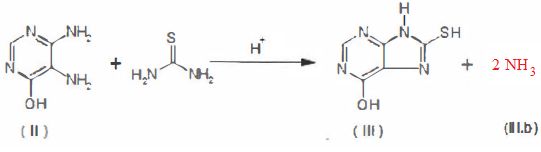
La
4,5-diamino-6-hydroxypyrimidine (II) réagit avec de la thiourée pour
donner la 6-hydroxy-8-purinethiol (III). Compléter l'équation de la
réaction en trouvant la structure de (III.h) affectée du coefficient
stoechiométrique adéquat.
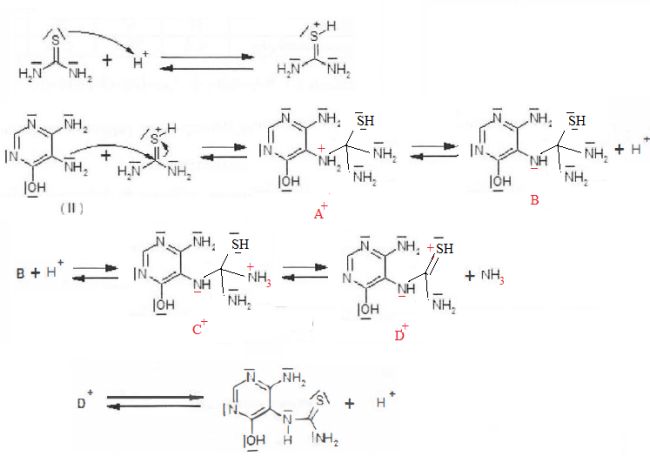
On donne le début du mécanisme de formation de (III) à partir de (II).
Déterminer les structures de A+, B. C+ et D+.
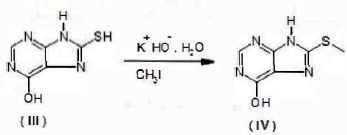
Un
mélange de 6-hydroxy-8-purinethiol (III) et d'eau réagit avec de
l'hydroxyde de potassium KOH en présence de glace de façon à maintenir
le milieu réactionnel à 20 °C. De l'iodométhane CH3I est
ensuite ajouté puis le mélange est agité énergiquement pendant 30
minutes jusqu'à ce qu'une seule phase subsiste. La solution est alors
portée à ébullition, acidifiée avec de l'acide acétique et filtrée à
chaud. Après lavage et séchage à 120°C le produit obtenu est un composé
blanc de 6-hydroxy-8-méthylthiopurine (IV).
|
| .
. |
|
|
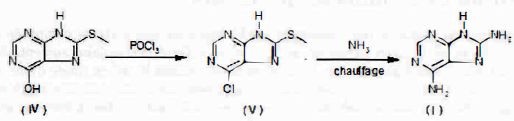
(IV) réagit ensuite avec POCl3 pour donner (V), qui, chauffé en présence de NH3, conduit à la 6,8-diaminopurine , produit qui doit être purifié et recristallisé.
Le composé que l'on souhaite récupérer à l'issue de la recristalisation a pour formule chimique C5H6N6,HCl,H20.
L'échantillon obtenu est ensuite caractérisé par une analyse
élémentaire dont les résultats sont précisés. H : 4,4 % ; C : 29,3 % ;
N : 41,1 % ; Cl : 17,4 %.
L'échantillon analysé est-il pur? Justifier quantitativement.
Hypothèse : l'échantillon est pur. M(C5H6N6,HCl,H20) =M =204,5 g/mol.
% C : 60 / 2,045 =29,3 % ; %N : 84/2,045 =41,1 % ; %Cl : 35,5 /2,045 =17,4 % ; %H = 9/2,045 =4,4%. L'hypothèse est vérifiée.
|
.
|