Méthodes
d'analyses d'espèces organiques.
Agrégation 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Combustion et analyse élémentaire
L'analyse des espèces chimiques permet la détermination de la
composition élémentaire des espèces chimiques, notamment des corps
composés. Elle est basée sur la combustion des espèces chimiques en
présence d'un excès de dioxygène.
Combustion en classe de quatrième.

1. Elaborer un scénario pédagogique.
Questions.
La chaleur dégagée par la combustion du charbon peut-elle contribuer à réchauffer la planète ?
L'un des produits issu de cette combustion contribue t-il à réchauffer la planète ? Qu'est ce que l'effet de serre ?
Hypothèse : la combustion du charbon produit du dioxyde de carbone et ainsi participe au réchauffement climatique.
Protocole expérimental :
dans un flacon rempli de dioxygène, introduire un morceau de fusain
inandescent. A la fin de lacombustion verser de l'eau de chaux dans le
flacon.
Observations et conclusion : la combustion du fusain est vive dans le dioxygène ; l'eau de chaux se trouble. L'hypothèse est bien vérifiée.
2. Ecrire l'équation de la réaction de combustion d'un hydrocarbure noté CxHy.
Expliquer succinctement, comment déterminer, à partir de cette combustion, la formule brute de l'hydrocarbure.
CxHy +(x +0,25 y) O2 ---> x CO2 + ½yH2O.
Afin de déterminer les quantités de chacun de ces éléments, on effectue une oxydation complète à l'air, d'une masse mA du composé A. Dans les CNTP, on recueille VCO2 L de dioxyde de carbone et mH2O grammes d'eau.
Masse molaire M = 12x+y ; quantité de matière de A : n = mA/M.
Quantité de matière de dioxyde de carbone : n x = x mA/M =x mA/(12x+y) ;
n x =VCO2 /Vm par suite x = VCO2 M / (Vm mA).
Quantité de matière d'eau : mH2O / MH2O = mH2O / 18 =0,5 n y = 0,5y mA/(12x+y).
Par suite y = mH2O M / (9mA).
Relation entre x et y : y = mH2O Vm/ ( 9 VCO2) x avec x et y entier.
3. La
combustion en présence de dioxygène d'une espèce organique contenant de
l'azote conduit à des espèces chimiques parfois identifiées par
l'acronyme NOx. Quel est la signification de cet acronyme ?
Oxydes d'azote.
Donner un exemple de NOx, son nom et sa formule de Lewis.
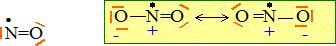
4. Ce
type de composé est également formé dans les les moteurs à combustion
interne des véhicules automobiles. Proposer l'équation de réaction de
formation de ces espèces NOx et indiquer pour quelles raisons cette
réaction se produit dans le moteur.
Les oxydes d'azote se forment lors de la combustion d'un carburant dans
des conditions de température et de pression élevées.
N2(air) + O2 ---> 2NO puis NO s'oxyde en NO2 en présence de dioxygène.
Indiquer quel dispositif technologique présent dans les automobiles
permet d'éliminer en partie les NOx et exposer son principe de
fonctionnement.
La technologie SCR consiste à réduire le NO2 présent dans les gaz d'échappement grâce à un catalyseur à réduction. Un additif (NH2CONH2 dilué) est injecté dans la ligne d'échappement en amont du catalyseur. Les oxydes d'azote sont réduits en N2.
|
| .
. |
|
|
Minéralisation et dosage de l'azote organique.
La
combustion des espèces chimiques ne permet pas le dosage de l'azote
organique ; la méthode généralement employée est celle de Kjeldahl, qui
consiste à minéraliser les composés organiques dans des conditions qui
permettent la formation d'ammoniac. L'ammoniac est dosé par un titrage
acide base.
La demande en aliment riches en protéines ( donc en azote organique )
augmente avec l'élévation du niveau de vie des populations. Pour
estimer la quantité de protéines dans certains aliments comme le lait
ou le blé, la méthode de Kjeldahl
est encore utilisée aujourd'hui. Les enjeux économiques considérables
ont conduit certaines entreprises à ajouter des composés pour augmenter
artificiellement le taux massique d'azote dans certains aliments.
5. A quelle(s) condition(s) l'ajout de composés dans les aliments permet-il d'en augmenter le taux d'azote?
Les protéines apportées
doivent être riches en acides aminés essentiels et posséder un bon
degré de digestibilité, afin que les acides aminés passent aisément
dans le sang. Par contre des
molécules très riches en élément azote comme la mélamine augmentent le
taux d'azote mais ont de graves conséquences rénales.
En
2008, du lait frelaté avec la mélanine à conduit à l''empoisonnement de
nombreux enfants. On donne la formule développée de la mélamine.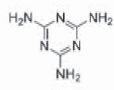
6. Le
taux moyen d'azote dans les protéines de l'alimentation est de 16 %.
Sur l'exemple de la mélamine, confirmer et justifier par un calcul
votre réponse précédente.
Masse molaire mélamine (C3H6N6 ): M = 3*12+6+14*6=126 g/mol.
% d'élément azote : 6*14/126 *100 ~66,7 %.
Ainsi 10 g de mélamine (
6,7 g d'élément azote ) ajouté à 100 g de protéines alimentaires
fait passer le taux moyen d'azote de 16% à (16+6,7) *100 / 110
=20,6 %.
|
.
|
|
A
l'occasion d'une opération de contrôle, un lot de lait de vache,
analysé au moyen de la méthode de Keeldahl, a révélé un taux massique
d'azote de 34,0 g par kilogramme de lait. Les lots fournis par le
producteur, par la même méthode d'analyse, donnaient habituellement une
valeur de 32,0 g d'azote par kilogramme de lait.
7. En considérant que la fraude est avérée, déterminer la quantité de mélamine ajoutée par kilogramme de lait.
2,0 g d'azote supplémentaire correpond à 2,0 / 0,667 ~3,0 g de mélamine ajouté par kilogramme de lait.
La DL50 de la mélamine chez le rat, par voie orale, est de 3,16 g / kg.
8. Que signifie DL50 ? Pour quelle raison la valeur 50 a-t-elle été retenue ?
Dose létale médiane : dose provoquant la mort de 50 % d'une population d'animaux dans des conditions expérimentales précises.
Pour
des raisons de représentativité statistique on utilise 50 % plutôt que
5%; 95 % ou 100 %. La courbe de Gauss étant plate vers 50 %, un
échantillon est plus représentatif lors du franchissement du seuil de
50 %.
9. La comparaison de la DL50 de la mélamine avec la
quantité ajoutée par kilogramme de lait fraudé permet-elle de
considérer que l'ajout de mélamine est sans effet ?
Chez l'homme la dose
journalière admissible est de 0,5 mg par kilogramme de poids corporel (
soit 0,5*50 = 25 mg pour une personne de 50 kg ).
Cette personne buvant un
quart de litre de lait par jour absorbe 0,75 g de mélamine, ce qui est
bien supérieur à la dose journalière admissible.
La toxicité est essentiellement rénale : formation de calculs rénaux, insuffisance rénale aiguë.
|
|
|