Synthèse
de la
frontaline : tosylate, SN2, saponification,
décarboxylation, cétal. Agrégation 2004
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
La
(-)frontaline, forme biologiquement active, est représentée :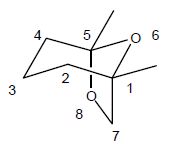
Quelles
sont les configurations absolues des centres asymétriques ? Combien
existe-t-il de stéréoisomères de cette molécule ? Quelle est la
signification du symbole (-) ?
Les atomes de carbone n°1 et n° 5 sont asymétriques. Les règles de
Cahn-Ingold-Prelog donnent leurs configurations absolues.
Pour le carbone C5 : O6 >
O8 > C4 > CH3.
Ce carbone est de configuration R.
Pour le carbone C1
: O6 > O7
> C2 > CH3.
Ce carbone est de configuration S.
Ces
deux atomes de carbone appartiennent à une structure rigide bicyclique
et sont liés à un atome d'oxygène : ils ne peuvent s'inverser que
simultanément : ils y a donc deux énantiomères ( (1S, 5R) et (1R, 5S).
Le
signe (-) signifie lévogyre. Cette molécule fait tourner vers la gauche
le plan de polarisation de la lumière polarisée.
1ère
étape.
On fait réagir l’alcool A sur le chlorure de l’acide
paratoluènesulfonique (noté TsCl dans la suite) en présence de pyridine
:
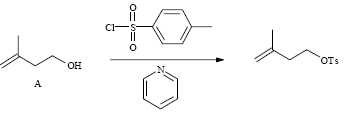
Donner le
nom de l’alcool A en nomenclature officielle.
3-méthylbut-3-én-1-ol.
Écrire
l’équation de la réaction. À quelle réaction importante des alcools
s’apparente la transformation réalisée ? Quel rôle
joue la pyridine dans cette réaction ?
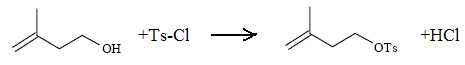
Cette réacction ressemble à l'estérification d'un alcool par un
chlorure d'acyle.
La pyridine, solvant basique, capte les protons libérés par la réaction.
Le but de cette étape est de former un excellent nucléofuge, l’ion
paratoluène-sulfonate TsO- .
Justifier
cette propriété de l’ion paratoluène-sulfonate. Quel autre groupe
aurait-on également pu substituer à –OH ?
L'ion paratoluène-sulfonate est stabilisé par résonance ; c'est une
base très faible et un bon nucléofuge.
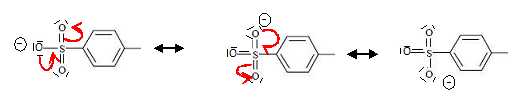
Le groupe hydroxyle aurait pu être remplacé par un halogène comme Br ou
I, les ions Br- et I-
sont de bons nucléofuges.
2ème
étape.
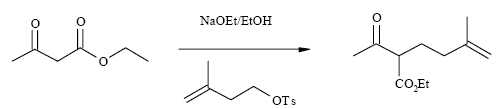
Comment
peut-on préparer simplement l’éthanolate de sodium NaOEt ?
Réaction d'oxydoréduction entre le sodium et l'éthanol :
Na(s) + C2H5OH
---> C2H5O-
+Na+ ½H2(g).
Quel
intérêt présente ici l’utilisation de cette base ?
C'est une base très forte qui de plus ne saponifie pas l'ester
( HO- peut saponifier l'ester ).
Donner
le mécanisme de la réaction en commentant notamment la molécularité de
sa seconde étape.
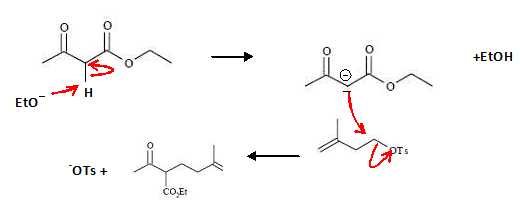
Le carbone porteur du groupe OTs est primaire. La substitution sera
donc bimoléculaire SN2.
|
| .
. |
|
|
3ème étape.
Cette
étape se déroule en deux parties : on traite d’abord le produit formé
dans l’étape précédente par la soude à chaud puis on revient en milieu
acide avant de chauffer à nouveau.
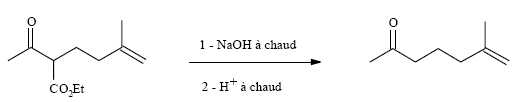
Donner
le mécanisme de la réaction avec la soude. Quel intérêt présente
l’utilisation d’un milieu basique par rapport à une hydrolyse en milieu
acide ?
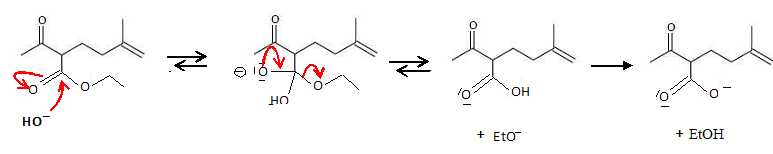
La
dernière étape est quantitative : réaction entre une base forte EtO-
et un acide faible RCOOH.
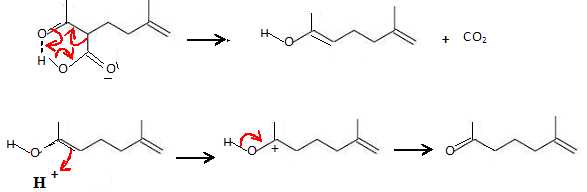
Lors de la
réaction en milieu acide, on observe un dégagement de dioxyde de
carbone.
Écrire le mécanisme de la réaction qui se déroule.
La
décarboxylation de l'acide est facilitée par l'existence d'une liaison
hydrogène intramoléculaire.
 |
.
|