Protéines
fluorescentes. Agrégation 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Phénomène de fluorescence.
Le
diagramme de perrin-Jablonski représenté ci-desous indique les niveaux
d'énergie relatifs aux différents états ( fondamental et excités )
d'une molécule organique ainsi que les temps caractéristiques (t) des
différents processus. On considère que la loi de décroissance d'une population n de molécules dans un état excité est du type :
n = n0 exp(-t/t).
Lorsqu'une
molécule est excitée par absorption dun photon, lentité moléculaire
résultante ( à durée de vie très brève ), se désexcite en libérant
l'énerie exédentaire par dissipation thermique ( processus non
radiatif), et, dans certains cas, par émission d'un photon. La
fluoresence correspond à l'émission d'un photon à partir d'un état
singulet ; la phosphorescence correspond à l'émission d'un photon à
partir d'un état triplet.
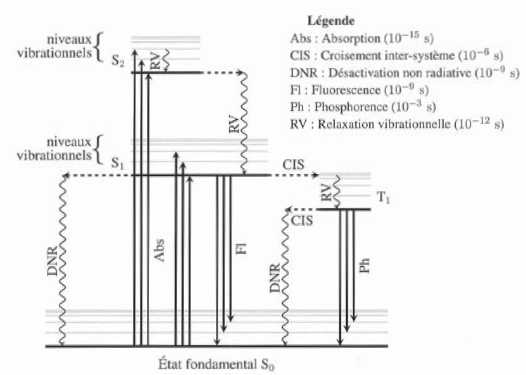
Les états fondamental et excités à gauche sont des états singulets ( S , ceux de droite sont des états triplets ( T).
35. Quelle est l'origine de cette différence entre les deux types d'état S et T ?
Etat singulet : tous les électrons sont appariès, lamultiplicité vaut 1.
Etat triplet : deux électrons ne sont pas appariés, la multiplicité vaut 3.
Les
molécules organiques existent à l'état fondamental dans l'état
singulet, la molécule de dioxygène existe àl'état fondamental dans
l'état triplet.
36. Justifier le fait que l'état fondamental du dioxygène est de de type triplet.
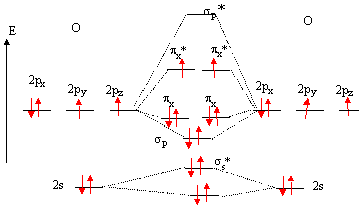
Deux électrons ne sont pas appariès, la molécule est dans un état fondamental de type triplet.
37.
Lorsque les photochimistes souhaitent travailler sur des entités
chimiques excitées dans des états triplets, ils procèdent à des
dégazages répétés des solvants de réaction. Justifier.
Il faut se
débarasser des gaz atmsphériques dissouts (en particulier le
dioxygène). Le dioxygène peut réagir avec des espèces à l'état triplet,
formées dans les réactions photochimiques, et les dégrader.
|
| .
. |
|
|
On
considère un groupe carbonyle (C=O) qui est irradié par une radiation
électromagnétique de longueur d'onde appropriée. La transition
électronique a pour effet de faire passer un électron d'un doublet non
liant de l'atome d'oxygène vers une orbitale antiliante p* de la liaison carbonyle. La distance carbone-oxygène dans le groupe carbonyle à l'état fondamental vaut d=120 pm.
38. Quelle sera la valeur de la distance carbone-oxygène dans le groupe carbonyle dans l'état Franck-Condon ?
Une
transition électronique se produit sans modification de la position des
noyaux dans l'entité moléculaire et son environnement. Cette
distance d ne varie pas.
39. Que peut-on attendre comme
modification de la distance carbone-oxygène dans le groupe carbonyle
dans le premier état excité singulet ?
L'indice de liaison est égal
àla moitié de la différence entre le nombre d'électrons occupant les OM
liantes et le nombre d'électrons occupant des OM antiliantes.
Un
électron non liant est passé d'une orbitale antiliante : l'indice de
liaison passe de 2 à 1,5. On peut s'attendre à une augmentation de la
distance carbone-oxygène du groupe carbonyle dans cet état excité.
La
règle empirique de Kasha indique qu'après l'absorption d'un photon par
une molécule dans l'état fondamental et le peuplement résultant des
états excités, l'émission radiative qui s'ensuit se produit à partir de
l'état excité de plus basse énergie.
40.
Justifier cette règle empirique.
La molécule est excitée en 10-15 s
et passe dans des états excités de différents niveaux électronique et
vibrationnel, puis elle se désexcite. La relaxation vibrationelle
est beaucoup plus rapide ( 10-12 s) que la fluorescence et la désactivation non radiative (10-9 s). La relaxation vibrationnelle se produit d'abord conduisant à un état excité singulet, la fluorecence se réalise ensuite.
Expérimentalement, on observe que les spectres d'émission et
d'absorption sont décalés ; ce décalage est appelé déplacement de
Stokes.
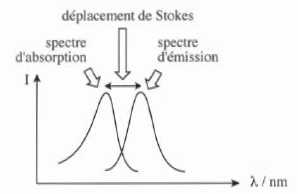
41. Expliquer l'origine de ce déplacement.
Le photon émis possède une énergie inférieure au photon absorbé du fait de la perte d'énergie par relaxation vibrationnelle.
Eémis < Eabsorbé ; E = h c / l ; lémis > l absorbé.
|
|
|
|
Inhibition de la fluorescence.
Processus d'absorption d'un photon : E +hn---> E*.
Il est considéré en première approximation comme indépendant de la présence des autres entités présentes dans le milieu.
L'émission d'un photon par fluorescence s'écrit : E* ---> E + hn' avec v = kfl [E*]. L'entité excité peut également revenir àl'état fondamental par un procesus non-radiatif : la désexcitation thermique.
On définit le rendement quantique de fluorescence FF
comme le rapport de la constante de vitesse du processus de
fluorescence sur la somme des constantes de vitesse de tous les
processus possibles de désexcitation. Ainsi lorsque la désexcitation se
produit uniquement par fluorescence ( kfl) et par voie thermique ( kth), le rendement quantique de fluorescence vaut :
FF = kfl / ( kfl+kth) avec kfl+kth = 1/t0, temps de vie de l'état excité.
Certaines
espèces chimiques, appelées quencher ( notés Q) ou inhibiteurs
possèdent la propriété d'inhiber la fluorescence. Le processus
d'inhibition résulte d'une collision entre l'entité à l'état excité et
le quencher avec libération d'énergie thermique ; on parle d'inhibition
dynamique ou collisionelle. Ce processus s'écrit : E*+Q---> E+Q
+transfert thermique. ( constante de vitesse kq)
42. Donner la molécularité et la loi de vitesse de ce processus d'inhibition.
La molarité de cette étape élémentaire vaut 2 et la loi de vtesse s'écrit v = kq[E*][Q].
43.
On iradie avec un flux lumineux constant une cellule contenant l'entité
E à exciter. Donner l'expression de d[[E*] /dt en présence et en
absence de quencher.
Absence de Q : processus de fluorescence et thermique. d[[E*] /dt =-(kth+kfl)[E*].
Présence de Q : compétition entre les processus précédents et l'inhibition :d[[E*] /dt =-(kth+kfl+kq[Q])[E*].
44.
On se place dans les conditions photostationnaires. La quantité
d'entité formée par irradiation est égale à la quantité d'entité
détruite par tous les processus possibles de désexcitation. Donner en
présence et en l'absence de quencher, l'évolution temporelle de la
concentration en entité excitée E*.
d[[E*] /dt =0.
45.
Etablir l'équation de Stern-Volmer écrite ci-dessous et donnant
l'évolution du rapport des rendements quantiques de fluorescence (Ff0/Ff) en fonction des concentrations en qencher Q, équation dans laquelle Ff0/Ff =1+kqt0[Q].
Ff0 : rendement quantique en absence de quencher ; Ff : rendement quantique en présence de quencher.
Absence de Q : d[[E*] /[E*]=-(kth+kfl)dt.
[E*] =[E*]0 exp(-(kth+kfl) t ).
Présence de Q : d[[E*] /[E*]=-(kth+kfl+kq[Q])dt.
[E*] =[E*]0 exp(-(kth+kfl+kq[Q]) t ).
Rendement quantique : Ff0 =kfl / (kth+kfl) = kfl t0.
Ff =kfl / (kth+kfl+kq[Q]) = kfl t0 / (1+t0kq[Q]).
Ff0/Ff =1+kqt0[Q].
On a reporté ci-dessous les droites de Stern-Volmer pour l'inhibition de fluorescence à différentes température croissantes de T1 à T5.
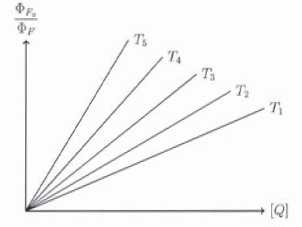
46.
Quel est l'effet d'une augmentation de la température sur l'inhibition
de la fluorescence ? Quelle raison peut-on évoquer pour expliquer cet
effet ?
L'inhibition croît avec la température. Le nombre de collisions croît avec la température, la constante de vitesse kq augmente.
|
|
|
Une deuxième forme d'inhibition de fluorescence a été observée, elle suit une loi de vitesse analogue à la précédente : Ff0/Ff =1+K[Q].
Cette
inhibition est dite statique : le quencher et l'espèce àl'état excité
E* réagissent l'un avec l'autre pour donner un complexe QE*, lequel ne
donne pas lieu à une fluorescence mais subit une désactivation
thermique. Les étapes du processus sont rassemblées dans la figure
suivante :

47.
Expérimentalement on observe dans ce cas que le rendement quantique
de fluorescence croît avec la température. Proposer une
explication.
Si le rendement croît, [QE*] diminue avec une
augmentation de température. L'explication est d'ordre thermodynamique
: une augmentation de température déplace l'équilibre vers la gauche. |
|