Carbonates
et silicates.
Concours agrégation 2004
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Solubilité du carbonate de calcium.
La solubilité de CaCO3
dans les eaux naturelles est régie par les échanges de matière aux
interfaces eau-atmosphère et eau-roche. L'’atmosphère, l’'humus ou les
remontées de gaz magmatiques fournissent du dioxyde de carbone CO2, la calcite CaCO3 apporte des ions CO32- et Ca2+.
La teneur en CO2 de l’'atmosphère qui était de 2×10-4 (0,02 % en volume) à la fin des années 1970 est aujourd’hui de 3,4×10-4. Dans l'humus, la pression de CO2
est d’'environ 0,1 bar et elle peut atteindre plusieurs dizaines de
bars dans les roches profondes des régions volcaniques (Massif Central).
Calculer la concentration du dioxyde de carbone CO2 dans une eau en équilibre avec l’atmosphère ainsi que le pH de cette eau.
CO2(g) = CO2aq(1). K1 = [CO2aq]P° /(C° PCO2)=3,2 10-2. [CO2aq] =K1C° PCO2/P°.
Pour une pression de 1 bar, [CO2aq] =3,2 10-2 *3,4 10-4 =1,088 10-5 ~1,1 10-5 mol/L.
Hypothèse : le pH est acide, on peut négliger l'équilibre acido-basique conduisant à CO32-.
CO2aq + 2H2O = HCO3-aq + H3O+aq. Ka1 =[HCO3-aq][H3O+aq]/[CO2aq]=10-6,2 =6,31 10-7.
| Avancement volumique ( molL) | CO2aq | + 2H2O | = HCO3-aq | + H3O+aq | | initial | 0 | 1,1 10-5 | solvant | 0 | 0 | | A l'équilibre | x | 1,1 10-5-x | x | x |
6,31 10-7 =x2/(1,1 10-5-x) ; x2+6,31 10-7 x -6,86 10-12 = 0.
Résoudre : D=2,786 10-11 ; D½ =5,278 10-6 ; x = 2,32 10-6 mol/L.
pH = -log x = -log(2,32 10-6) =5,6. L'hypothèse est bien vérifiée.
Écrire
la réaction de dissolution de la calcite dans une eau en équilibre avec
l’atmosphère. Calculer la constante d’équilibre de cette réaction.
Dans une eau contenant CO2aq : CaCO3(s) +CO2aq+H2O=Ca2+aq + 2HCO3-aq.
K2 =[Ca2+aq][HCO3-aq]2/[CO2aq].
K2 =[Ca2+aq] [CO32-aq] [H3O+aq][HCO3-aq]/[CO2aq] [HCO3-aq]/([H3O+aq][CO32-aq]).CaCO3(s) =Ca2+aq + CO32-aq. Ks = [Ca2+aq][CO32-aq]=10-8,3 =5,01 10-9.
CO32-aq +H3O+aq = HCO3-aq +H2O ; 1/Ka2 =[HCO3-aq]/ ([H3O+aq][CO32-aq])=1/10-10,2 =1/(6,3 10-11).
K2 = Ks Ka1 / Ka2 =10-8,3* 10-6,2/10-10,2)= 10-4,3=5,0 10-5.Calculer la solubilité de la calcite dans cette eau ainsi que le pH de la solution saturée.
Hypothèse : [CO32-aq] négligeable.
Electroneutralité de la solution : 2 [Ca2+aq] =[HCO3-aq].
K2 = 4[Ca2+aq]3/[CO2aq] ; [Ca2+aq] =(K2[CO2aq]/4)1/3 =(5,0 10-5 *1,1 10-5/4)1/3 =5,16 10-4 ~5,2 10-4 mol/L.
Soit 5,16 10-4 M(CaCO3 )=5,16 10-4*100,1 ~0,052 g/L = 52 mg/L.
Par suite [HCO3-aq]=2*5,16 10-4 ~1,032 10-3 mol/L.
pH = pKa1 + log( [HCO3-aq]/[CO2aq]) =6,2 +log( 1,032 10-3/(1,088 10-5 )=6,2 +1,98 ~8,2.
On vérifie l'hypothèse : [CO32-aq] =Ka2[HCO3-aq] /[H3O+aq] =10-10,2*1,032 10-3 /10-8,2=1,0 10-5 mol/L.
|
| .
. |
|
|
Une
eau minérale gazeuse est prélevée par forage à environ 90 mètres.
Lorsque l’'eau atteint la pression de 5,5 bar, appelée « point de bulle
», elle dégaze et il faut maintenir une pression d’'au moins 3,5 bar
pour éviter l‘'obturation du forage.
Interpréter le comportement de l’eau minérale lors de sa remontée en surface. Quel phénomène est à l’origine de l’obturation ?
CO2(g) = CO2aq(1).
CaCO3(s) +CO2aq+H2O=Ca2+aq + 2HCO3-aq (2). K2 = 5,0 10-5.
Sous forte pression, la calcite se dissout : (2) évolue dans le sens direct.
Lors
de la remontée, la pression totale diminue, l'eau dégaze : l'équilibre
(2) évolue dans le sens indirect ( formation de calcite ).
Déterminer la composition de l’eau de la nappe (en supposant qu’elle ne contienne pas d’autre minéral dissous que CaCO3).
[CO2aq] =K1C° PCO2/P°= 3,2 10-2 *5,5 =0,176 ~0,18 mol/L.
A partir d' une pression de 3,5 bar, l'eau commence à dégazée et [CO2aq] = 3,2 10-2 *3,5 =0,112 mol/L.
Le produit de solubilité de la calcite est atteint : K2 =[Ca2+aq][HCO3-aq]2/[CO2aq].
[Ca2+aq][HCO3-aq]2 =K2 [CO2aq] =5,0 10-5 *0,112 =5,6 10-6.
Or 2[Ca2+aq] =[HCO3-aq] ; 4[Ca2+aq]3=5,6 10-6.
[Ca2+aq] ~1,1 10-2 mol/L et [HCO3-aq]~2,2 10-2 mol/L.
|
.
|
|
Silicates et aluminosilicates.
Les structures de ces composés peuvent ent se décrire à partir du tétraèdre Si O44−.
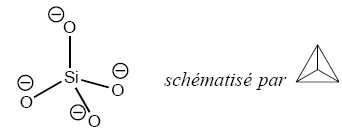
Les
enchaînements, finis ou infinis, donnent lieu à une grande variété de
composés. Les tétraèdres peuvent en effet se lier par deux, trois ou
quatre sommets, l'’atome d’'oxygène d'’un sommet étant alors commun aux
tétraèdres liés. Ils donnent ainsi naissance à des cycles, des chaînes,
des plans ou des structures tridimensionnelles.
Donner la formule brute du composé tridimensionnel. Dans quel minéral est-il présent ?
Chaque oxygène est commun à deux tétraèdres. Formule brute SiO2, la silice.
L’enstatite est un silicate de magnésium formé de très longues chaînes de tétraèdres associées à des ions magnésium :
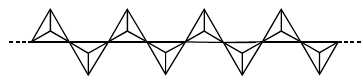
Écrire la formule semi-développée. En déduire que la formule brute est MgSiO3.
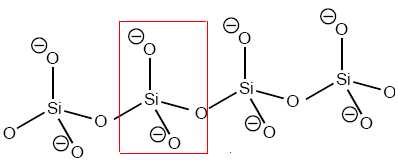
Dans les aluminosilicates, une partie des atomes de silicium est remplacée par des atomes d’aluminium.
Montrer que la structure contient alors nécessairement des cations supplémentaires.
L'aluminium
ne compte que 3 électrons externes ( 4 pour le silicium ). En
remplaçant un atome de silicium par un atome d'aluminium, on intoduit
une charge négative. Des cations supplémentaires seront nécessaires.
Parmi
ces aluminosilicates, les zéolithes (étymologiquement : “pierre qui
bout”) jouent un rôle grandissant dans l’industrie et au laboratoire.
Le schéma suivant est celui de la zéolithe ZK5. On voit que
l’'enchaînement des tétraèdres détermine des cages et des canaux dont
les dimensions sont variables et peuvent, en grande partie, être fixées
au cours de la synthèse. Par ailleurs ces cavités sont plus ou moins
encombrées par des cations (ici, des ions Na+) suivant la proportion d'’aluminium dans la structure.
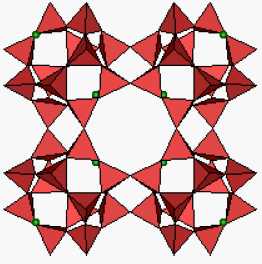
Pourquoi observe-t-on un dégagement de vapeur d’eau lors du chauffage de ces zéolithes ?
Une structure poreuse absorbe de l'eau ; celle-ci solvate les cations de la structure.
Les
cations sont facilement échangés et remplacés par des protons. Les
zéolithes ainsi échangées deviennent des catalyseurs acides extrêmement
efficaces dont l'’activité tient à la fois à la présence des sites
acides et à la sélectivité apportée par la taille des canaux empruntés
par les réactifs ou produits et par la taille des cavités sièges des
réactions. Ces zéolithes acides sont utilisées dans la valorisation des
hydrocarbures tirés du pétrole. En phase gazeuse, l’'alkylation du
toluène par le méthanol, en présence d’'acide, conduit à un
mélange de xylènes CH3C6H4CH3 qui s'’isomérise en un mélange en équilibre thermodynamique
contenant
26% d’'orthoxylène, 24% de paraxylène et 50% de métaxylène alors que
l’'utilisation d’une zéolithe (ZSM-5) permet d’obtenir sélectivement le
paraxylène, réactif de base de nombreuses synthèses.
|
|
|
Les zéolithes utilisées dans l’industrie pétrolière sont en général pauvres en aluminium. Proposer une explication.
En
présence de cations supplémentaires, la zéolithe devient hydrophile ;
dans l'industrie du pétrole, les zéolithes peu hydrophiles sont
recherchées.
Quels
sont, d’après les règles de Hollemann, les produits majoritaires
attendus lors de l’alkylation du toluène par le méthanol, en présence
d’un catalyseur acide. Donner le mécanisme réactionnel.
Le groupe méthyle est donneur : il active les positions ortho et para du cycle benzénique. 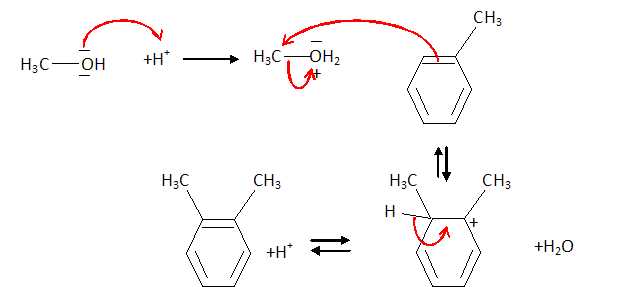
De même pour la position para.
Pourquoi obtient-on un résultat différent lors de la réaction en phase gazeuse ?
Les
règles de Hollemann s'appliquent lors d'une compétition sous contrôle
cinétique : le produit majoritaire est celui qui se forme le plus vite.
En phase gazeuse la compétition est sous contrôle thermodynamique : le produit majoritaire est le plus stable.
Si
l’on effectue la réaction à travers une zéolithe acide, on constate
qu’on peut atteindre une sélectivité allant jusqu’à 87% de paraxylène
pour une zéolithe convenablement choisie.
Proposer une interprétation. Comment doit-on choisir la zéolithe utilisée ?
La
réaction se déroule à l'intérieur des cavités acides ; les xylènes
diffusent ensuite à travers les canaux. On choisit une zéolithe telle
que la taille des canaux ne laissent sortir que le paraxylène.
|
|
|