Plate forme
pétrolière : recyclage des matériaux de l'ouvrage. Bts Travaux
publics 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Partie C -
Recyclage des matériaux de l’ouvrage (7 points)
Une grande partie de la structure contient une forte quantité de
ferraille. Les centres de tri récupèrent la ferraille usagée afin de la
retraiter pour le transformer en profilé IPN (poutrelles de
construction métallique). Suivant le pourcentage de fer d’une
ferraille, son prix de rachat varie énormément. Si un échantillon de
ferraille contient entre 50 et 92% de fer (pourcentage en masse), la
ferraille est « pauvre » en fer, elle intéresse peu les industriels et
ne se vend pas cher. Au contraire, si la ferraille contient plus de 92
% de fer (en masse), elle est « riche » en fer et se vend cher.
On souhaite déterminer le pourcentage de fer dans de la ferraille
récupérée sur le site. Pour cela on réalise un dosage dit « en retour
». On fait réagir avec un excès connu de solution d’acide fort le fer
contenu dans une masse donnée de ferraille. On neutralise ensuite
l’acide restant, à l’aide d’une solution de base forte. La
neutralisation de l’acide permet d’accéder à sa quantité de matière
restant après réaction avec le fer, puis de connaître la quantité de
matière du fer qui a réagi.
1. Étude de la première réaction entre le
fer et l’acide fort.
L’acide fort utilisé pour réagir avec le fer est représenté par les
ions oxonium, H3O+.
12. Justifier que
le dégagement gazeux observé est un dégagement de dihydrogène.
Le fer est le réducteur le plus fort, il s'oxyde : Fe(s) = Fe2+aq
+ 2e-.
L'ion H3O+est
l'oxydant le plus fort, il se déduit : 2H3O+aq+ 2e- = H2(g) +2H2O(l).
Fe(s) +2H3O+aq= Fe2+aq +H2(g) +2H2O(l).
13. Montrer que la quantité de
matière d’acide fort introduite dans l’erlenmeyer vaut noxonium = 5,0.10-2
mol.
V = 25 mL d'acide fort de concentration c = 2,0 mol/L.
n = CV = 2,0 *0,025 =5,0.10-2 mol.
|
| .
. |
|
|
2. Étude
de la réaction de neutralisation de l’acide fort restant par
l’hydroxyde de sodium.
La base forte utilisée pour neutraliser l’acide fort restant après
réaction avec le fer est de l’hydroxyde de sodium. On la représente par
les ions hydroxyde HO-.
14. Écrire
l’équation bilan de la réaction mise en jeu au cours de la
neutralisation de l’acide fort par l’hydroxyde de sodium.
H3O+aq
+ HO-aq --> 2H2O(l). (1)
15.
Schématiser et légender le montage permettant la neutralisation de
l’acide fort par l’hydroxyde de sodium en indiquant où se trouvent les
solutions utilisées.
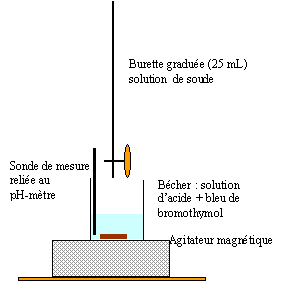
|
|
|
|
16. Proposer en argumentant son choix, un indicateur coloré adapté à
cette neutralisation.
Le pH du point équivalent est égal à 7. La zone de virage de l'indicateur coloré doit contenir cette valeur pH = 7.
Le bleu de bromothymol convient.
On note nrestant la quantité de matière de l’acide fort neutralisé dans
cette réaction et nb la quantité de matière de base forte versée pour atteindre l’équivalence,
c'est-à-dire la neutralisation.
17. Exprimer la relation entre nrestant et nb puis montrer que
nrestant = 1,6.10-2 mol.
Concentration de la base Cb = 1,0 mol/L ; volume versé à l'équivalence VE = 16 mL.
A l'équivalence, d'après les nombres stoechiométriques de (1) : nrestant = nb = Cb VE =1,0 *0,016 = 1,6 10-2 mol.
On remarque que, pendant la neutralisation, il apparaît un précipité
verdâtre qui disparait lors de l’agitation.
18. Indiquer, en justifiant la réponse, quelle peut être la cause de
cette précipitation.
Formation d'hydroxyde de fer II Fe(OH)2 solide verdâtre.
3. Exploitation des résultats expérimentaux.
Pour exploiter complètement le protocole, il faut remonter à la
quantité de matière initiale de fer, nFe ayant réagi au départ. On montre que nFe , noxonium et
nrestant sont liées par la relation :
nrestant = noxonium – 2 nFe .
19. L’échantillon de ferraille est-il un échantillon « riche » ou «
pauvre » en fer ?
Argumenter soigneusement la réponse.
nFe = ( noxonium –
nrestant ) / 2 =(5 10-2 -1,6 10-2) / 2 =0,017 mol.
M(Fe) = 55,8 g/mol ; masse de fer : mFe =nFe M(Fe) =0,017 *55,8 ~0,95 g dans 1,0 g d'échantillon de ferraille. ( 95 %).
La ferraille est riche en fer.
|
|
|
|