Titre
alcalimétrique, acide citrique, aspartame, étude d'un jet d'eau. Bts
QIABI 2014.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Détermination
d'untitre alcalimétrique (TA).
1.1 . Définir ampholyte.
Un ampholyte peut se comporter comme un acide ou une base. Exemple HCO3-,
acide du couple HCO3-/CO32-
et base du couple H2CO3
/HCO3-.
1.2.
Indiquer sur un axe gradué en pH, les domaines de prédominance des
espèces H2CO3 ; HCO3- ; CO32-
.
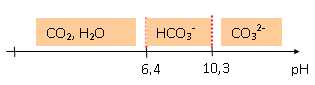 1.3. Le pH d'une
eau minérale est 7,4. Quelle est la forme prédominante à ce
pH ?
1.3. Le pH d'une
eau minérale est 7,4. Quelle est la forme prédominante à ce
pH ?
HCO3- prédomine à pH =
7,4.
-
On verse quelques gouttes de phénolphtaléine dans la solution ;
indiquer la teinte prise par cet indicateur cloré.
Cet indicateur est incolore à pH = 7,4.
-
Expliquer pourquoi le TA de cet eau est nul.
Le
TA est égal au volume d'acide chlorhydrique de concentration 0,0200
mol/L , nécessaire pour doser 100 mL d'eau en présence de
phénolphtaléine. Celle-ci étant incolore le volume d'acide
chlorhydrique à ajouter est nul.
Détermination
d'un TAC.
2.1.
Quel matériel doit-on utiliser pour mesurer le volume V0 =50,0 mL d'eau
à analyser.
Un
volume précis doit être mesuré à l'aide d'une pipette jaugée ou d'une
fiole jaugée de 50,0 mL.
2.2. Quelle réaction
se produira lors du dosage ?
HCO3-aq +H3O+aq
---> CO2 )aq +2 H2O(l).
Comment faire pour préparer la solution titrante de concentration Cac
= 2,00 10-2 mol/L à partir d'une solution de
concentration 0,100 mol/L ?
Facteur de dilution F = 0,100 /(2,00 10-2)=5 ;
Dans une fiole jaugée de 100 mL contenant un tiers d'eau distillée,
ajouter 20 mL ( volume prélevé à la pipette jaugée) de solution
concentrée. Compléter jusqu'au trait de jauge à l'aide d'eau distillée.
Agiter pour rendre homogène.
2.2.1.
Dans ce cas justifier que le TAC ( en mL) est égal à deux fois VE(
en mL).
Le
TAC est déterminé à partir du dosage de 100 mL d'eau et non pas de 50
mL comme dans le cas présent.
2.2.2.
Etablir l'expression littérale de la concentration massique Cm
en ions hydrogénocarbonate. En déduire parmi les formules proposées
ci-dessous, celle qu'il faut introduire dans la cellule J9 du tableur
pour corriger l'erreur de l'opérateur.
A l'équivalence [HCO3- ]
=Cac VE/
V0 =2,00 10-2 VE
/ 0,050 =0,40 VE.
M(HCO3-)
= 61 g/mol ; Cm = [HCO3-
] M(HCO3-)
= 0,40*61 VE = 24,4 VE.
Si VE = 0,0166 L, Cm
= 24,4*0,0166 =0,40 g/L.
Cm = Cac
VE / V0 M(HCO3-).
Case J9 du tableur :
= E5*H9*E4 / E3. ( réponse A).
|
|
|
Acide citrique, l'aspartame.
1. Nommer la grandeur portée sur l'axe des ordonnées d'un spectre infrarouge.
La transmittance.
2. Préciser le phénomène physique qui est à l'origine de l'absorption d'énergie par la molécule, dans le domaine infrarouge.
Vibrations et déformations angulaires des liaisons.
3.
Ecrire la formule semi-développée de l'acide citrique et entourer les
groupes d'atomes à l'origine des deux bandes d'absorption vers 1750 cm-1.
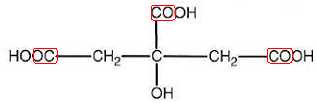
4. Sur le spectre infrarouge, deux bandes d'absorption se superposent : l'une est située entre 2500 et 3200 cm-1 ( bande A), l'autre entre 3000 et 3500 cm-1
( bande B). Identifier sur la formule semi-développée de l'acide
citrique, le(s) groupe(s) d'atomes responsable(s) de la bande A et de
la bande B.
Bande B : alcool OH lié par liaison hydrogène ; bande A : acide carboxylique OH lié par liaison hydrogène.
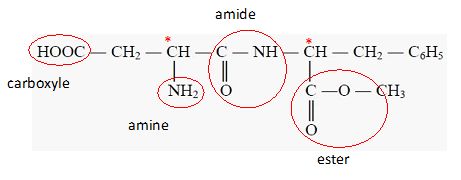
5.1.
On donne la formule semi-développée de l'aspartame. Identifier les
fonctions acide carboxylique ( carboxyle ), ester ainsi que la liaison
peptidique ( amide).
5.2. Par hydrolyse acide on obtient trois produits dont le méthanol. Ecrire la formule du méthanol.
CH3-OH.
- Nommer la fonction chimique qui par hydrolyse donne cet alcool.
Fonction ester.
Les deux autres produits sont des acides a-aminés
issus de l'hydrolyse acide de la liaison peptidique : l'acide
aspartique et la L-phénylalanine. Par déduction retrouver la formule de
la phénylalanine.
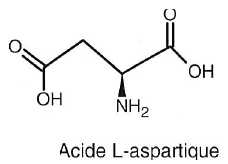 | 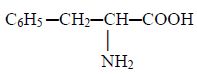
Phénylalanine |
.- Expliquer la phrase " contient une source de phénylalanine" mentionnée sur l'étiquette.
L'hydrolyse de l'aspartame se déroule dans l'estomac ( pH compris entre 1,5 et 5) : celle-ci libère de la phénylalamine.
5.3.
Ecrire la représentation de Fischer de l'acide L-aspartique. En déduire
sa configuration R ou S. Justifier clairement en classant les
groupements. Ecrire une représentation de Cram de l'acide L-aspartique.
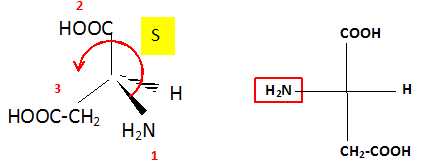
|
|
|
|
Etude
d'un jet d'eau.
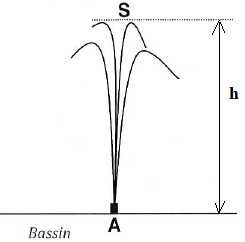
Un groupe de pompes installé
sur une conduite aspire de l'eau et la projette verticalementàl'air
libre au point A situé à la même altitude que la surface libre du
bassin. L'eau s'élève à une hauteur h = 10,0 m au desus de la surface
libre du bassin.
En A, le diamètre du jet est d = 45 mm. On néglige les frottements de l'eau avec l'air.
Le cycle frigorifique réversible, parcouru dans le sens ABCD, est
donné. La transformation BC est isentropique.
1. Théorème de Bernoulli. r v2 / 2 +r g z +p = cste.
Donner le sens des termes du membre de gauche.
r : masse volumique de l'eau ( kg m-3) ; v : vitesse d'une particule du fluide ( m / s) ; z :altitude en mètre et p pression en pascal.
2. Détermination de la vitesse de l'eau en A.
Le point A à la base du jet est soumis à la pression atmosphérique.
On applique le théorème de Bernoulli entre A et S.
r v2A / 2 +r g zA +pA= r v2S / 2 +r g zS +pS=cste.
pA=pS= pression atmosphérique ; vS=0, ( sommet du jet ) ; zA =0, origine des altitudes.
v2A / 2 = g h ; vA =(9,81*10*2)½ = 14,0 m/s.
3. Détermination du débit volumique du jet en A.
Qv = SA VA avec SA = pd2/4 = 3,14 *0,0452 /4 =1,59 10-3 m2.
Qv = 1,59 10-3*14,0 =2,2266 10-2 ~2,23 10-2 m3 s-1.
4.
Détermination du rendement.
4.1. Le rendement hydraulique
peut être défini comme le rapport entre la hauteur atteinte et la
hauteur théorique du jet. Il vaut 90 %.
Calculer la hauteur théorique du jet.
10,0 / 0,90 = 11,1 ~11 m.
4.2. La puissance hydraulique vaut Phydrau = 81,5 kW et la puissance consommée par les pompes est Ppompes = 102,0 kW.
Déterminer le rendement des pompes.
Phydrau / Ppompes =81,5 / 102,0 = 0,799 ( 79,9 %).
4.3. Calculer le rendement global.
0,799 * 0,90 = 0,719 ~0,72 ( 72 %).
|
|
|
|