Toxicité du
mercure dans l'eau. Bts Métiers de l'eau 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1.
Généralités
1.1- Préciser
l’état physique du mercure dans les conditions normales de température
et
de pression.
Le mercure est un liquide dans les conditions normales de température
et de pression.
1.2- Citer une
utilisation possible, aujourd’hui limitée, du mercure métallique dans
des
appareils de mesure de grandeurs physiques.
Thermomètre, baromètre, fabrication d'électrode au calomel.
1.3- Écrire la
structure électronique de l’ion Hg2+.
[Xe] (4f)14(5d)10 .
1.4- Indiquer les
consignes de sécurité à suivre en cas d’utilisation de mercure au
laboratoire.
Port de gants et lunettes de protection. Travail sous hotte aspirante,
les vapeurs étant toxiques ; ne pas jeter à l'évier, le mercure étant
écotoxique.
1.5- Sachant que la
température d’ébullition de l’or est de 2856 °C, expliquer
succinctement comment les orpailleurs peuvent simplement séparer l’or
et le mercure après les avoir amalgamés.
La température d'ébullition du mercure étant de 356 °C, il suffit de
chauffer l'amalgame.
1.6- Préciser alors
le risque encouru par les orpailleurs.
Ils respirent des vapeurs de mercure très toxiques.
2- Diagramme potentiel-pH
de l’élément mercure.
L’étude est conduite à 25 °C.
Le diagramme potentiel pH du mercure est représenté à 25 °C, pour une
concentration totale
en mercure en solution C0 égale à 0,01 mol.L–1.
En pointillés est représentée la droite frontière
entre O2 et H2O.
2.1- Indiquer à quelle espèce chimique correspond chacun des domaines.
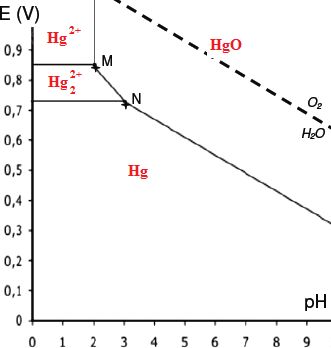
2.2- Retrouver par le calcul le pH de précipitation de l’espèce HgO(s)
pour une concentration de l’élément mercure en solution C0 égale à 0,01 mol.L–1.
HgO(s) +H2O(l) =Hg2+aq +2HO-aq (l) pKs =26 à 25°C.
[Hg2+aq] [HO-aq]2 = 10-26 ; [HO-aq]2 = 10-26 /0,01 = 10-24 ;
[HO-aq] = 1,010-12 mol/L ; [H3O+aq] =0,010 mol/L ; pH = 2.
2.3- Écrire la demi-équation électronique relative au couple Hg22+(aq) / Hg(l), puis exprimer
le potentiel E en fonction de E°, potentiel standard de ce couple, et
de laconcentration molaire C0 des ions Hg22+(aq).
Hg22+(aq) +2e- = 2Hg(l).
E = E°(Hg22+(aq) / Hg(l)+0,03 log [Hg22+(aq)]
E = E°(Hg22+(aq) / Hg(l))+0,03 log c0.
2.4- Calculer la valeur de E°.
Les coordonnés (pH ; E) du point M sont (2,0 ; 0,85) et celles du point N (3,0 ; 0,73).
Au point N : 0,73 = E°(Hg22+(aq) / Hg(l)) +0,03 log 0,01 ;
E°(Hg22+(aq) / Hg(l)) =0,73 -0,03 log 0,01 =0,79 V.
|
| .
. |
|
|
2.5- Prévoir si le mercure métallique est attaqué en milieu acide fort
désaéré. Justifier la réponse.
Tous les espèces sont stables en présence d'eau. L'eau et toutes les espèces contenant l'élément mercure ont un domaine commun.
2.6- Le mercure métallique subit une corrosion en milieu humide aéré à
pH égal à 7.
Il se transforme en oxyde mercurique HgO(s).
Justifier cette proposition et écrire l’équation de la réaction de
corrosion du mercure.
On écrira les demi-équations électroniques des couples impliqués dans
cette réaction.
Par contre le mercure liquide est attaqué par le dioxygène dissout.
Hg(l) + 3H2O(l) = HgO (s)+ 2H3O+aq + 2e-.(1)
½O2aq +2H3O+aq+ 2e- = 3H2O(l). (2)
Hg(l) + ½O2 aq = HgO (s).
2.7- Exprimer la constante
d’équilibre K de cette réaction, puis la calculer à l’aide des valeurs
des potentiels standards des couples mis en jeu. Proposer une
conclusion.
K = 1/ [O2aq]½.
E1 = E°(HgO (s) / Hg(l)) +0,03 log[H3O+aq]2 .
E2 = E°(O2aq /H2O) +0,03 log(1/([H3O+aq]2[O2aq]½)).
A l'équilibre : E1 =E2 ;
E°(HgO (s) / Hg(l)) +0,03 log[H3O+aq]2 =E°(O2aq /H2O) +0,03 log([H3O+aq]2[O2aq]½).
E°(O2aq /H2O)-E°(HgO (s) / Hg(l)) = -0,03 log [O2aq]½= 0,03 log K.
0,03 log K = 1,23-0,91 =0,32 ; log K = 0,32 / 0,03 = 10,6 ; K = 4,6 1010.
K est grand, la réaction est totale.
|
|
|
|
3- Courbes intensité-potentiel.
L’étude est conduite à 25 °C.
On considère l’électrolyse d’une saumure, solution aqueuse concentrée de chlorure de sodium (Na+(aq) + Cl–(aq)).
On donne les potentiels standards desdifférents couples redox
susceptibles d’être mis en jeu dans le système étudié, ainsi que les
courbes intensité-potentiel pour deux cathodes de natures différentes :
une cathode en acier d’une part (courbes 3a) et une cathode en mercure
d’autre part (courbes 3b), l’anode étant en titane dans les deux cas.
E°(H+(aq)/H2(g)) = 0,00 V ; E°(O2(g)/H2O(l)) = 1,23 V ; E°(Cl2(g)/Cl–(aq)) = 1,36 V ; E°(Na+(aq)/Na(s)) = – 2,71 V.
3.1- Effectuer le bilan de toutes les espèces chimiques présentes dans la solution.
Na+(aq) ; Cl–(aq) ; H+(aq) ; HO-aq ; H2O(l).
3.2- Indiquer parmi ces espèces celles qui sont susceptibles d’être oxydées et celles qui sont susceptibles d’être réduites.
Na+(aq), H+(aq), H2O(l) peuvent être réduites. H2O(l), HO-aq peuvent être oxydées.
3.3- D’après les
valeurs des potentiels standards, écrire la demi-équation électronique
de la réaction que l’on devrait observer d’un point de vue
thermodynamique à l’anode d’une part et à la cathode d’autre part,
quelle que soit la nature de ces électrodes.
Réduction de l'ion H+(aq) à la cathode négative : 2H+aq +2 e- = H2(g).
Oxydation de l'eau à l'anode : H2O(l) = ½O2(g) + 2H+aq + 2e-.
3.4-
En analysant les courbes intensité-potentiel du document 3a, préciser
l’espèce réellement formée à la cathode en acier et l’espèce réellement
formée à l’anode. Justifier la réponse.
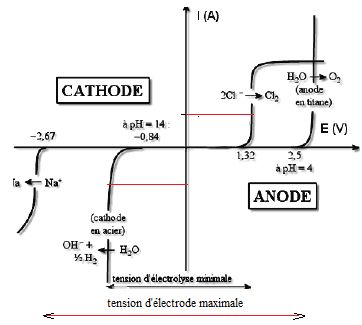
Dégagement de dihydrogène à la cathode et de dichlore à l'anode.
Surtension moyenne du dihydrogène sur cathode d'acier et grande surtension du dioxygène sur anode de titane.
3.5- En analysant
les courbes intensité-potentiel du document 3b, préciser l’espèce
réellement formée à la cathode de mercure. Justifier la réponse.
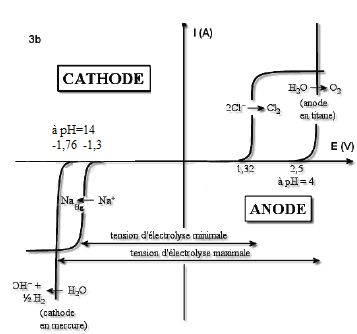
Dépôt de sodium à la cathode et dégagement de dichlore à l'anode.
Grandes surtensions du dihydrogène sur cathode de mercure et du dioxygène sur anode de titane.
3.6- Indiquer quel
type d’électrode on doit choisir pour produire du sodium, utilisé en
industrie nucléaire ou en synthèse organique.
Cathode de mercure.
|
|
|
|