Etude
d'anti-inflammatoires. Bts chimiste 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Les
anti-inflammatoires non-stéroïdiens présentent une grande diversité de
structure chimique mais ont un mode d’action biologique commun : ils
inhibent la synthèse de prostaglandines, molécules intervenant dans le
processus inflammatoire mais également dans l’agrégation plaquettaire,
la protection de l’estomac et la fièvre.
Les anti-inflammatoires stéroïdiens présentent une plus grande
homogénéité de structure : ce sont tous des stéroïdes, lipides
possédant un noyau stérane composé de quatre cycles accolés selon le
squelette :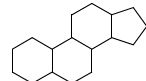
Dans ce sujet, quatre molécules possédant des propriétés
anti-inflammatoires seront étudiées. Leurs formules topologiques sont
représentées.
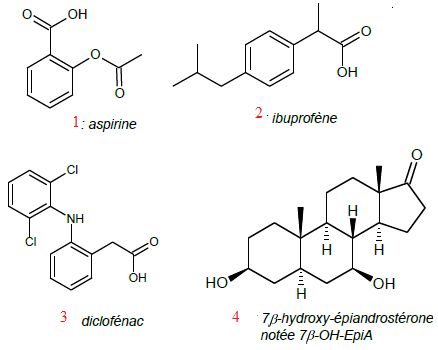
Comparaison des formules des
quatre molécules étudiées.
Parmi les quatre molécules représentées, identifier celle(s) qui
appartien(nen)t à la catégorie des anti-inflammatoires stéroïdiens et
celle(s) qui appartien(nen)t à la catégorie des anti-inflammatoires non
stéroïdiens. Justifier.
Seule (4) possède une
structure stérane. (4) est un
anti-inflammatoire stéroïdien ; 1, 2 et 3 sont des anti-inflammatoires
non stéroïdiens.
Préciser quel groupe caractéristique est commun à toutes les molécules
représentées appartenant à la catégorie des anti-inflammatoires non
stéroïdiens.
Le groupe carboxyle COOH
est présent dans les molécules 1, 2, 3.
L’aspirine ou acide
acétylsalicylique.
L’acide acétylsalicylique est un des principes actifs les plus utilisés
avec une consommation mondiale annuelle estimée à 40 000 tonnes, soit
l'équivalent de 120 milliards de comprimés de 300 mg. Il est prescrit
pour ses propriétés antalgiques (qui diminuent la douleur),
antipyrétiques (qui diminuent la fièvre), anti-inflammatoires et
d’antiagrégant plaquettaire.
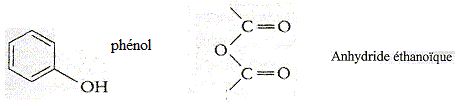
La synthèse industrielle de l’acide acétylsalicylique s’effectue à
partir de phénol et d’anhydride acétique (ou anhydride éthanoïque).
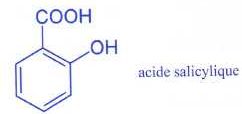
Dans un premier temps, on prépare l'acide salicylique (ou acide
2-hydroxybenzoïque) à partir du phénol par la réaction de Kolbe.
L’acide salicylique réagit ensuite avec l’anhydride éthanoïque pour
former l’acide acétylsalicylique.
Le procédé industriel fait intervenir les étapes suivantes :
- Étape 1 : Du phénol pur est introduit dans un réacteur avec une
quantité stoechiométrique d’hydroxyde de sodium (solution à 50 %). En
fin de transformation, l’eau présente dans le réacteur est éliminée par
évaporation sous vide. Un solide est alors obtenu.
- Étape 2 : Le solide obtenu est introduit dans un autoclave broyeur
avec du dioxyde de carbone sous pression pour former du salicylate de
sodium.
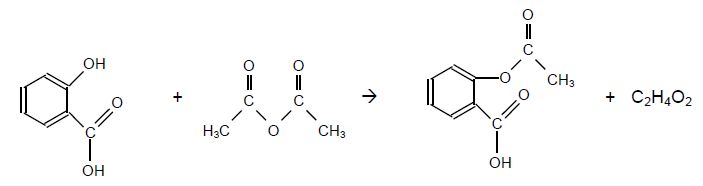
- Étape 3 : De l’acide sulfurique est ajouté au salicylate de sodium.
- Étape 4 : À une température voisine de 98 °C, de l’anhydride
éthanoïque est ajouté au produit issu de l’étape 3. L’acide
acétylsalicylique est isolé par filtration après refroidissement à 0 °C.
Donner les formules topologiques du phénol et de l’anhydride éthanoïque.
Écrire l’équation de la réaction associée à la première étape du
procédé industriel. Nommer le solide obtenu.
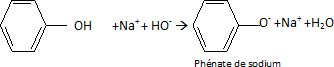
Donner la formule topologique et le nom de l’espèce chimique obtenue à
l’issue de l’étape 3.
Écrire l’équation de la réaction modélisant l’étape 4.
|
| .
. |
|
|
L’ibuprofène ou
acide 2-(4-(2-méthylpropyl)phényl)propanoïque.
L’ibuprofène a été développé dans les années soixante par les
Laboratoires Boots. Ce médicament est prescrit à faible dose pour son
effet antalgique et antipyrétique car son effet anti-inflammatoire
n’apparaît qu’à des doses plus élevées (au-delà de 1 200 mg/jour chez
l’adulte).
L’énantiomère de configuration absolue S de la molécule possède une
activité biologique beaucoup plus élevée que l’énantiomère de
configuration absolue R. Toutefois, dans l’organisme, l’énantiomère de
configuration absolue R est rapidement transformé en énantiomère de
configuration absolue S par une enzyme épimérase : l’α-méthylacyl-CoA
racémase. L’inversion de configuration n’a pas lieu pour l’énantiomère
de configuration absolue S dans l’organisme.
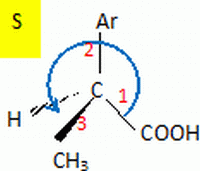
Représenter l’énantiomère de configuration absolue S de l’ibuprofène en
justifiant la réponse.
Numéroter
de
façon décroissante chacun des quatre substituants
selon son numéro atomique.
COOH
(1) ; Ar (2) ; -CH3
(3)
; H (4).
On
place alors l'atome
(ou le groupement) de numéro le plus élevé
derrière.
On
regarde dans quel
sens, sens horaire ou trigonométrique, on passe du
numéro 1, au 2, au 3.
-
Si le sens de rotation
est le sens horaire (ou anti-trigonométrique),
le carbone est Rectus (R),
- Si le sens de rotation
est le sens trigonométrique (ou anti-horaire),
le carbone est Sinister (S).
L’ibuprofène est commercialisé
sous forme de racémique. Qu’est-ce qu’un racémique (ou mélange
racémique) ?
Les deux énantiomères
sont présents en quantité équimolaire dans un racémique.
Indiquer quelle proportion des molécules d’ibuprofène contenues dans un
comprimé aura une activité biologique. Justifier.
L’énantiomère
de configuration absolue S de la molécule possède une activité
biologique beaucoup plus élevée que l’énantiomère de configuration
absolue R.
|
.
|
|
Le diclofénac
Le diclofénac est une molécule possédant des propriétés antalgiques,
antipyrétiques, anti-inflammatoires et d’inhibition de courte durée des
fonctions plaquettaires.
Il est notamment prescrit en cas de douleurs liées à des inflammations
articulaires, à de l'arthrose, à des tendinites ou pour traiter des
oedèmes. Il est présent dans le Voltarène®.
Une voie de
synthèse du diclofénac présente les étapes indiquées sur la figure
suivante (les étapes d’hydrolyse ou de modification du pH du milieu
réactionnel ne sont pas indiquées). La molécule A est synthétisée à
partir de l’acide 2-chlorobenzoïque selon la réaction d’équation
suivante :
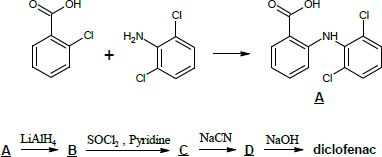
Donner les formules topologiques des molécules B, C et D.
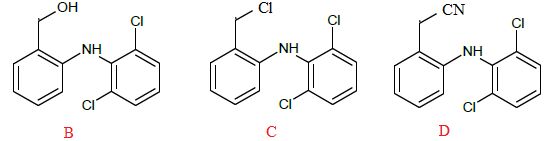
Indiquer à quel type de réaction correspond la transformation C
--> D. Préciser le type de réactivité de l’ion cyanure dans cette
transformation.
Substitution nucléophile
monomoléculaire, le carbocation intermédiaire étant stabilisé par
résonance. L'ion cyanure est un nucléophile.
Nommer la transformation mise en jeu lors de la formation du diclofénac
à partir de la molécule D en précisant la fonction chimique de D ayant
réagi.
L'hydratation d'un
nitrile conduit dans un premier temps à l'amide. La transformation se
poursuit par hydrolyse de l'amide. Selon la nature du milieu ( acide ou
basique) on obtient l'acide carboxylique ou l'ion carboxylate.
Une notation simplifiée de la molécule E pourra être utilisée et
l’acide paratoluènesulfonique, qui joue le même rôle que l’acide
sulfurique concentré, pourra être noté H+.
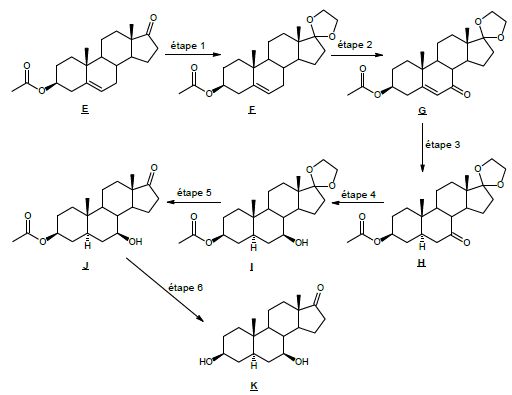
En considérant l’ensemble des étapes de cette synthèse, indiquer
quel est l’intérêt de la première étape. Justifier avec précision la
réponse.
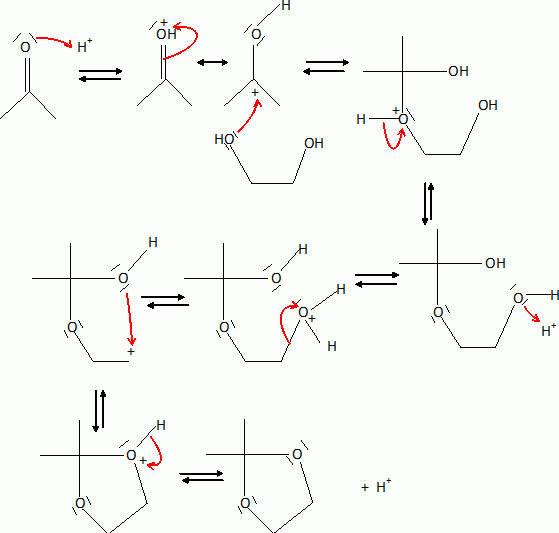
Écrire l’équation de la réaction mise en jeu lors de cette étape.
Proposer un mécanisme pour la réaction mise en jeu lors de cette étape.
Protection du carbonyle par formation d'un acétal cyclique afin que cette cétone ne soit pas réduite dans l'étape 4.
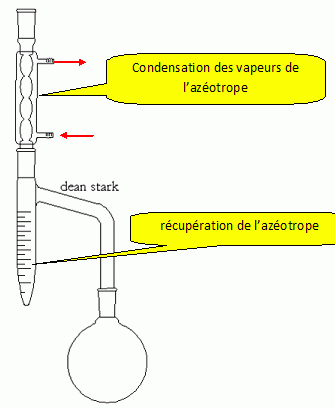
Indiquer l’intérêt de
l’utilisation d’un appareil de Dean-Stark lors de cette étape. Une
réponse détaillée est attendue, indiquant notamment le principe de
fonctionnement de l’appareil de Dean-Stark.
Le but d'un appareil
de Dean-Stark est d’enlever l’eau du milieu ( augmentation du rendement de la synthèse). Pour cela, on ajoute un
solvant afin de former avec l’eau un hétéroazéotrope dont la
température d’ébullition sera la plus faible de tous les composés
présents.
|
|
Parmi
les étapes 1 à 6, identifier les trois étapes qui correspondent à une
oxydation ou une réduction ; préciser, pour chacune de ces trois
étapes, s’il s’agit d’une oxydation ou une réduction.
Etape 2 : oxydation de CH2 en C=O ( cétone). Etape 4 : réduction de la cétone en alcool. Etape 6 : réduction de l'ester en alcool.
Le spectre infrarouge de la molécule J présente une bande autour de 3450 cm-1 et deux bandes à 1735 et 1725 cm-1. Préciser les vibrations correspondant à ces différentes bandes d’absorption.
Autour de 3450 cm-1 : liaison OH ; 1735 cm-1 : liaison C= O ester ; 1725 cm-1 liaison C=O cétone.
Citer deux changements observés en RMN (13C) lors de la transformation J-->K.
Disparition des deux signaux correspondant aux atomes de carbone du groupe CH3-COO ( ester réduit en alcool).
Afin
de caractériser le récepteur de la 7-hydroxy-épiandrostérone dans le
corps humain, cette même équipe a proposé la synthèse d’un dérivé
(molécule U) selon le schéma de synthèse suivant.
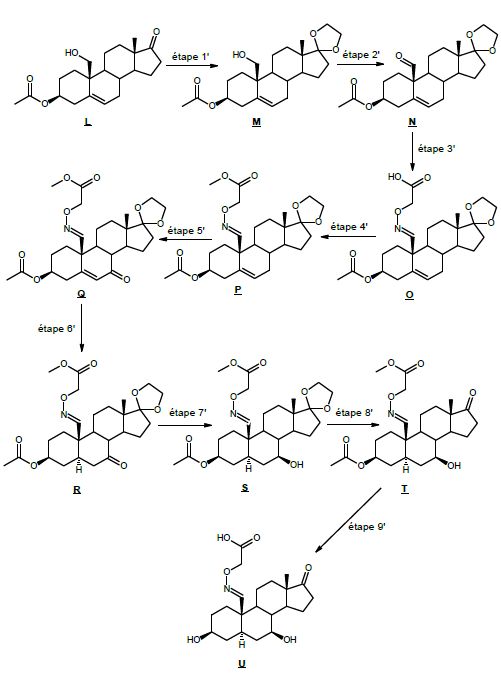
Citer trois étapes de la synthèse de T qui correspondent à des
transformations analogues à celles mises en jeu lors de la synthèse de
K ?
Etape 1 et étape 1' : protection d'une cétone. Etape 3 et étape 5' : passage de CH2 à C=O. Etape 6 et étape 9' : réduction d'un ester en alcool
Proposer un ou des réactifs pour réaliser la transformation M-->N.
Oxydation ménagée d'un alcool primaire en aldéhyde : CrO3Py2 dans le dichlorométhane.
Proposer une formule de réactif comprenant une liaison azote-oxygène pour réaliser la transformation N-->O.
H2N-O-CH2-COO-CH3.
La transformation O-->P a été réalisée en utilisant du diazométhane CH2N2, gaz jaune toxique et explosif, en solution dans de l’éther diéthylique.
La solution de diazométhane a été ajoutée lentement à une solution de O
dans un mélange éther/méthanol (2/1) à 0 °C. La fin de l’addition a été
déterminée par l’observation d’une coloration jaune persistante du
milieu réactionnel (obtenue après une heure d’addition).
La transformation N-->P (étapes 2’ et 3’) a été alors effectuée avec un rendement de 95 %.
Préciser pourquoi la coloration jaune persistante du milieu réactionnel sert d’indicateur de fin d’addition.
Le diazotméthane en solution dans l'éther est en excès quand le réactif O a été entierement consommé.
Sachant qu’un gaz se forme au cours de la transformation et constitue
le seul produit secondaire obtenu, écrire l’équation de la réaction
mise en jeu lors de la transformation O-->P. Nommer le gaz formé.
Une notation simplifiée de P et O pourra être utilisée.
Méthylation douce d'un ion carboxylate par le diazométhane, base forte qui arrache le proton de l'acide carboxylique.
R-COOH + CH2N2 ---> RCOO-CH3 + N2 ( diazote).
|
|
|