Synthèse
de l'acide hippurique. Olympiades chimie
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
On
done la formule topologique de l'acide hippurique : 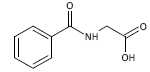 . Sachant
que le suffixe « para » signifie que les deux substituants sont sur des
atomes de carbone diamétralement opposés, quelle est
la formule topologique de l'acide para-aminohippurique ? . Sachant
que le suffixe « para » signifie que les deux substituants sont sur des
atomes de carbone diamétralement opposés, quelle est
la formule topologique de l'acide para-aminohippurique ?

Pourquoi
dit-on que la glycine 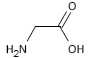 est un
acide a-aminé
? est un
acide a-aminé
?
Cette molécule possède une fonction acide carboxylique et une fonction
amine portées par le même carbone.
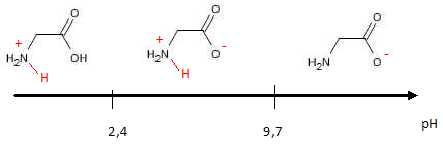
La
glycine possède deux fonctions ayant des caractères acido-basique : les
fonctions carboxyle et amino. On lui associe donc deux constante
d'acidité pKa1= 2,4 (associé au groupe acide
carboxylique) et pKa2= 9,7 ( associé au groupe
amine). Proposer
un diagramme de prédominance des espèces de la glycine en solution dans
l’eau.
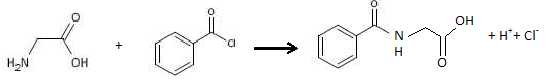
 Ecrire
l’équation de la réaction entre la glycine et le chlorure de benzoyle. Pour simplifier, on écrira la
glycine sous une forme non ionisée.
Ecrire
l’équation de la réaction entre la glycine et le chlorure de benzoyle. Pour simplifier, on écrira la
glycine sous une forme non ionisée.
Synthèse :
- Préparer un montage à reflux avec un ballon bicol, un réfrigérant et
un agitateur magnétique.
- Introduire environ 20 mL de solution saturée d’hydrogénocarbonate de
sodium dans le ballon.
- Peser une masse m = 1,00 g de glycine et l’introduire également dans
le ballon.
- Mettre sous agitation vigoureuse.
-
Ajouter, dans le ballon, goutte à goutte environ 1 mL de chlorure de
benzoyle (mesuré grossièrement à la pipette pasteur). On observe alors
une effervescence.
- Laisser agiter à température ambiante pensant environ 45 minutes.
Calculer
la quantité de glycine qui a été introduite dans le ballon.M(glycine)
= 75,1 g/mol.
n 1=M / M(glycine) = 1,00 / 75,1 =1,3316 10 -2
~1,33 10 -2 mol.
Si on suppose que la réaction est totale et que l’on admet que le
chlorure de benzoyle est introduit en excès, quelle
quantité d’acide hippurique peut-on espérer obtenir à l’issue de la
synthèse ? Calculer
la masse correspondante. M(acide hippurique) =179,2 g/mol.
n =n 1= 1,33 10-2 mol ; m = n M(acide
hippurique) =1,3316 10-2 *179,2
=2,39 g.
|
| .
. |
|
|
Lors
de la synthèse, en plus de l’acide hippurique, on obtient de l’acide
benzoïque. Quelle
réaction parasite permet d’expliquer la formation de l’acide benzoïque
?
Hydrolyse du chlorure de benzoyle.
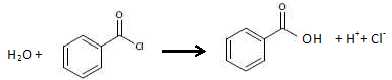
La solution d’hydrogénocarbonate de sodium utilisée lors de la synthèse
a un pH de 8,3. Sous
quelle forme se trouve l’acide benzoïque qui apparait dans le ballon
? pKa ( acide benzoïque / ion benzoate) =4,2.
A pH supérieur à pKa, la forme base du couple,
l'ion benzoate, prédomine.
Au
bout d’environ 45 minutes :
-
Acidifier le mélange réactionnel avec 25 mL de solution d’acide
chlorhydrique et vérifier si on a pH = 1. Il se forme alors des
cristaux (d’acide hippurique et d’acide benzoïque) dans le ballon.
- Filtrer l’ensemble sur Büchner.
-
Arrêter l’aspiration et prélever une pointe de spatule de ces cristaux
et les mettre dans un tube à hémolyse (tube n°1) contenant un fond
d’acétate d’éthyle.
- Ajouter environ 5 mL d’éther diéthylique dans
le büchner et mélanger bien avec les cristaux. Remettre en marche
l’aspiration, puis renouveler l’opération une fois. (récupérer l’éther
diéthylique dans un bidon.)
- Prélever une pointe de spatule des
cristaux restant et les mettre dans un tube à hémolyse (tube n°2)
contenant un fond d’acétate d’éthyle.
- Sécher les cristaux restant au mieux et récupérer les dans une boite
de pétri préalablement tarée.
Expliquer
pourquoi les cristaux d’acide benzoïque apparaissent lorsque l’on
ajoute de l’acide chlorhydrique dans le ballon.
Le
pH de la solution devient très inférieur au pKa
du couple (
acide benzoïque / ion benzoate). La forme acide, l'acide benzoïque
prédomine. Or celui-ci est très peu solule à froid dans l'eau. Il va
donc précipiter.
Expliquer
pourquoi, lors du lavage des cristaux, on arrive à séparer l’acide
hippurique de l’acide benzoïque ? L'acide
benzoïque est très soluble dans l'éther, alors que l'acide hippurique y
est très peu soluble.
|
.
|
|
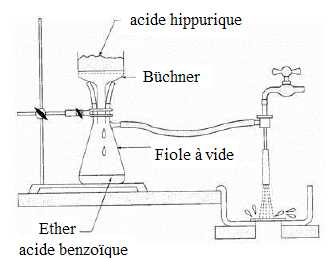
Le schéma suivant représente
l’opération de filtration sous vide. Ajouter
les mots suivants
: éther – acide benzoïque – acide hippurique – büchner – fiole à vide,
afin qu’il représente ce que l’on obtient à l’issue du lavage des
cristaux avec l’éther diéthylique.
 |
Dépôt n°1 : contenu du tube à hémolyse n°1
(cristaux avant lavage à l’éther)
Dépôt n°2 : contenu du tube à hémolyse n°2 (cristaux après lavage à
l’éther)
Dépôt n°3 : solution d’acide benzoïque dissout dans l’acétate d’éthyle.
Que pouvez-vous
conclure du chromatogramme obtenu en lors de l’étape de caractérisation.
Le dépôt 3 sert de référence ( acide benzoïque ).
Le tube n°1 contient l'acide benzoïque et l'acide hippurique ; le tube
n°2 ne contient que l'acide hippurique. |
On obtient, après purification, une
masse mAH = 1,79 g d’acide hippurique. Quel est
le rendement de cette synthèse ?
Rendement = masse expérimentale / masse théorique = 1,79 / 2,39 =0749 ~
0,75 ( 75 %).
Expliquer
pourquoi ce rendement ne peut pas être égal à 100%.
Une partie du chlorure de benzoyle est hydrolysé ; il y a des pertes de
matière lors des lavages.
Pour
identifier le produit formé lors de la synthèse, on peut
utiliser la spectrométrie RMN du proton.
On donne le spectre RMN du proton correspondant à l’acide
hippurique. Attribuer
un signal en RMN à chaque groupe de protons chimiquement équivalents.
(Attention, pour des raisons que nous n’expliquerons pas ici, le proton
de la fonction acide carboxylique ne donne aucun signal sur le spectre
RMN)
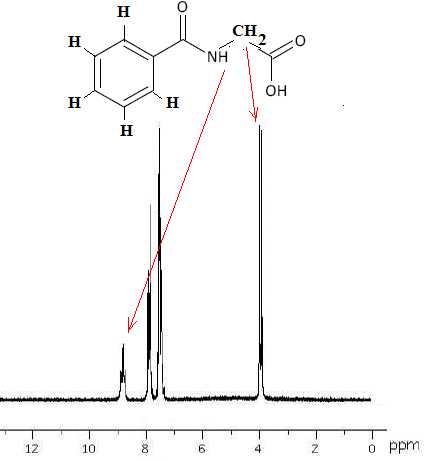
Le proton du groupe amide donne le pic vers 9 ppm.
Les deux protons équivalents du groupe CH2
donnent le signal vers 4 ppm.
Les protons du cycle benzénique donnent le signal vers 7,8 ppm.
|
|
|