Bâtiment
à énergie positive.
Bac Sti2d 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Le Matériau à Changement de Phase (MCP) des dalles de mortier.
Les plafonds et planchers seront construits avec des dalles de mortier dont les alvéoles contiennent un MCP.
Les
MCP très utilisés dans le bâtiment sont à base de paraffines ; le
choix, qui dépend entre autres de la température de changement d’état
solide-liquide et de l’enthalpie de fusion, doit se faire entre
l’heptadécane C17H36 et l’octadécane C18H38.
Les MCP à base de paraffines sont des matériaux organiques. Pourquoi
sont-ils qualifiés d’organiques ? Expliquer brièvement pourquoi un MCP permet de limiter les besoins en
chauffage.
Les paraffines,constituées de carbone et d'hydrogène, sont des molécules organiques.
Lors
d'un changement d'état physique ( entre 18°c et 28°C dans le cas des
MCP ), de l'énergie est absorbée lors de la fusion( quand la
température s'élève) ; cette énergie est restituée lors de la
solidification quand la température baisse.
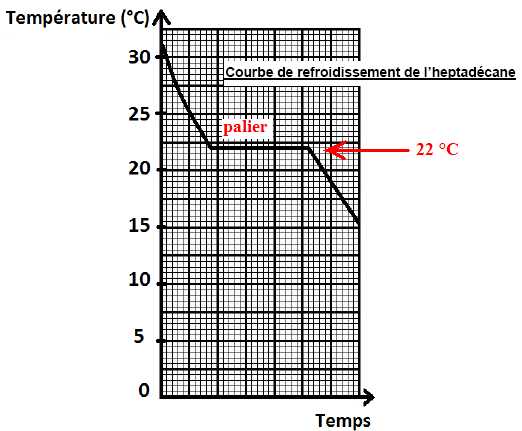
On
détermine dans un premier temps la température de changement d’état
solide-liquide de l’heptadécane. Expliquer ce qui a lieu au
niveau microscopique lors de la solidification de l’heptadécane.
Les molécules sont moins agitées et la structure devient ordonnée.
Déterminer la température de changement d’état solide-liquide de l’heptadécane.
L’enthalpie de fusion de l’heptadécane est déterminée expérimentalement. Effectuer un bilan
énergétique pour en déduire l’enthalpie de fusion de l’heptadécane.
Vérifier que la valeur obtenue est Hf = 2,35.102 kJ.kg-1.
La
valeur absolue de l'énergie cédée par m = 0,200 kg d'eau ( corps
chaud) est égale à l'énergie gagnée par m' =0,015 kg de l'heptadécane (
corps froid), soit 3,52 103 J.
3,52 103 / 0,015 = 2,35 105 J kg-1.
Dans les conditions de l’expérience précédente, on admet que l’incertitude de l’enthalpie de fusion
est telle que :UHf / Hf = UE eau / Eeau où UE eau = 0,4.103 J et Eeau = 3,53.103 J.
Citer deux sources d’erreurs possibles dans cette expérience.
Le calorimètre et ses accessoires participent aux échanges thermiques ; erreur sur la pesée de l'heptadécane.
Calculer avec un chiffre significatif l’incertitude de mesure de l’enthalpie de fusion de l’heptadécane.
UHf = UE eau Hf / Eeau = 0,4.103 *2,35.105 /( 3,53.103 ) =2,7 104 J ~30 kJ.On
présente souvent un résultat de mesure sous la forme d’un intervalle
encadrant la valeur exacte avec une probabilité de 95%. Les limites de
l’intervalle sont :
valeur minimale = résultat de la mesure – 2 x l’incertitude calculée ;
valeur maximale = résultat de la mesure + 2 x l’incertitude calculée.
Calculer les valeurs encadrant la mesure de l’enthalpie de fusion.
Hf =235 ±60 kJ.kg-1 ; 175 < Hf < 295.Voici
les renseignements trouvés pour l’octadécane, qui est l’autre matériau
à changement de phase proposé par le chef de projet :
la température de changement d’état solide-liquide : 28°C ; l’enthalpie de fusion : Hf octadécane = 244 kJ.kg-1. Quel MCP conseillez-vous ? Justifier votre réponse.
Les
enthalpies de fusion sont pratiquement identiques. On choisira le MPC
ayant le plus bas point de fusion , la température de 28 °C étant
rarement atteinte au printemps et à l'automne dans de nombreuses régions.
|
|
|
Les fenêtres.
Pour
les fenêtres, deux modèles ont été sélectionnés pour
finaliser le choix. Une étude est effectuée pour une fenêtre de
surface 1 m2.

Calculer la résistance thermique Rth,triple d’une surface de 1m2 du triple vitrage avec lames d’air.
Rth = R th air + R th verre = 2*0,46 + 3*3,3 10-3 ~0,93 K W-1.
Faut-il plutôt choisir la fenêtre double vitrage à lame de krypton ou la fenêtre triple vitrage à lames d’air ? Justifier.
On choisit la fenètre la plus isolante, ayant la lus grande résistance thermique : double vitrage et krypton.
Panneaux solaires.
Des panneaux solaires photovoltaïques doivent couvrir une surface de 98 m2.
Sous quelle forme d’énergie utile le panneau photovoltaïque transforme-t-il l’énergie solaire ?
L'énergie solaire est en partie convertie en énergie électrique.
Les
panneaux solaires photovoltaïques doivent contenir du silicium
polycristallin. Calculer l’énergie minimale qu’un photon doit posséder
pour « arracher » un électron du réseau du silicium. Exprimer le
résultat en joule.
L’énergie du photon doit au moins être égale à 1,12 eV soit 1,12 *1,6 10-19 =1,8 10-19 J.
Sachant que la vitesse d’une onde électromagnétique dans l’air est c = 3,0.108 m /s, montrer que la longueur d’onde l de l’onde associée à ce photon est 1,1.10-6 m.
l = h c / E = 6,62 10-34 *3,00 108 / (1,8 10-19) =1,1 10-6 m.
A quel domaine du spectre solaire ce photon appartient-il ?
Cette valeur étant supérieure à 0,8 10-6 m, le photon appartient au proche infrarouge.
Sachant que chaque panneau photovoltaïque, de surface égale à 1,65 m2, peut produire une puissance maximale de 235 W, calculer la puissance maximale que peuvent fournir les 98 m2 de panneaux photovoltaïques que l’on envisage d’installer sur le toit.
235*98 / 1,65 =1,396 104 ~1,4 104 W.
En
considérant un ensoleillement de 12 h en moyenne par jour, on montre
que ces panneaux photovoltaïques peuvent produire une énergie de 2,2.1011 J en une année. Vérifiez que ce résultat est correct.
E = P t = 1,396 104 *12*365 =6,1 107 Wh ou 6,1 107 *3600 =2,2 1011 J.
Expliquer
pourquoi les panneaux photovoltaïques triple jonctions sont plus
performants que les panneaux photovoltaïques au silicium polycristallin.
Une cellule au silicium polycristallin absorbe seulement 20 % des radiations visible et IR.
Une cellule triple jonction absorbe 55 % des UV (soit environ 0,55 *5 ~ 3 % du spectre solaire ), 20 % du visible (soit environ 0,20 *50 ~ 10 % du spectre solaire ) et 40 % des IR (soit environ 0,40 *40 ~ 16 % du spectre solaire ). Total 29 % du spectre solaire.
|
.
|
|
Les éoliennes.
Le bâtiment doit être équipé de deux éoliennes.
Les pales d’une éolienne en rotation sont soumises à plusieurs actions mécaniques, dont celle exercée par le vent et le poids.
Citer une troisième action mécanique qui s’exerce sur la pale d’une éolienne en rotation.
Les frottements sur les couches d'air.
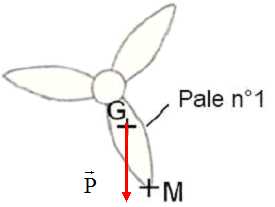
Modéliser
le poids de la pale n°1, sachant que sa valeur vaut 7600 N. Le point M
est situé à l’extrémité de la pale et le point G le centre de gravité
de la pale.
Échelle : 1,0 cm représente 4000 N.
L’action du vent peut être modélisée par deux forces :
la portance, qui permet de faire tourner le rotor ;
la trainée, qui est une résistance aérodynamique dont la valeur est donnée par la relation : T =½Cx r S v2 où Cx est le coefficient de trainée ; il n’a pas d’unité.
r est la masse volumique de l’air ; elle s’exprime en kg.m-3.
S est la surface balayée par les pales de l’éolienne ; elle s’exprime en m2.
v est la vitesse du vent ; elle s’exprime en m.s-1.
À partir des unités des grandeurs physiques, vérifier que la trainée est une force.
[r S v2] = M L-3 L2 L2 T-2 = M L T-2 ( kg m s-2).
Une force est une masse fois une accélération et une accélération est un distance divisée par un temps au carré.
[T] =M L T-2 ( kg m s-2).
Lorsque
la vitesse du vent est suffisante, les pales se mettent en mouvement ;
elles exercent alors un couple de forces plus ou moins important sur le
rotor.
Calculer la valeur C du moment du couple de forces
exercé par les pales de l’éolienne, lorsqu’elles effectuent un tour
complet.
Données : travail d’un couple de forces = moment du couple en N.m * angle de rotation en rad.
Travail du couple W = 2,0.102 J ; 1 tour = 2prad = 360 °.
C = 2,0 102 / (2*3,14) =31,85 ~32 N m.
En déduire la valeur de la puissance mécanique P d’une éolienne lorsque la vitesse angulaire N vaut 1500 tr/min.
P = C w avec w =2pN/60 =2*3,14 *1500 / 60 = 157 rad/s.
P = 32*157 = 5,0 103 W.
Bâtiment BEPOS.
La consommation annuelle du bâtiment est estimée à 66 MW.h.
Le bâtiment sera équipé :
de
deux éoliennes ; pour chaque éolienne, la durée moyenne de
fonctionnement et la vitesse moyenne du vent permettent d’estimer que
l’énergie électrique produite est de 8,0.103 kW.h ; de panneaux solaires, qui fourniront 2,2.1011 J. Pensez-vous que le bâtiment entrera bien dans la catégorie BEPOS ? Justifier.
Energie totale fournie : 2*8,0 + 2,2 1011 / (3,6 109)= 77 MWh.
Ce bâtiment produit plus d'énergie qu'il n'en consomme : il appartient à la catégorie BEPOS.
|
L'utilisation de l'hydrogène.
Comme l’électricité produite en surplus ne peut pas être stockée, elle sera utilisée pour produire du dihydrogène H2, qui sera stocké dans des récipients adaptés.
Lorsque
des besoins apparaitront, le dihydrogène stocké alimentera alors une
pile à hydrogène : l’énergie libérée servira pour le chauffage et
l’électricité alimentera le bâtiment (chauffage électrique d’appoint,
éclairage, …).
Le stockage du dihydrogène.
Le
dihydrogène, substance inflammable et explosive, sera stocké dans les
locaux du bâtiment. Pour des raisons d’encombrement, il sera comprimé
sous une pression très élevée dans des réservoirs adaptés. Quel
instrument de mesure permettra de contrôler la pression du dihydrogène
dans les réservoirs de stockage ? Un manomètre.
Quels pictogrammes devront être apposés sur ces réservoirs ?

Gaz inflammable sous pression, risque d'explosion.
La pile à combustible.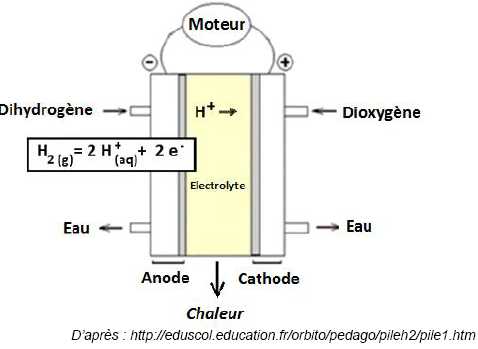
Lorsque le bâtiment aura besoin d’électricité, il fera fonctionner sa pile à combustible, alimentée par le dihydrogène stocké.
Répondre au questionnaire à choix multiple en cochant la bonne réponse.
Les porteurs de charge qui de déplacent dans l’électrolyte de la pile sont : des photons ( faux) ; des électrons
(faux) ; des ions ( vrai).
L’équation de la réaction qui a lieu à la cathode s’écrit : la réduction du dioxygène a lieu à la cathode ; l'oxydant O2 gagne des électrons.
O2 (g) + 4 H+ (aq) = 2 H2O (l) + 4 e-. ( faux ).
2 H2O (l) = O2 (g) + 4 H+ (aq) + 4 e-. ( faux).
O2 (g) + 4 H+ (aq) + 4 e- = 2 H2O (l). (Vrai ).
Le couple oxydant / réducteur mis en jeu à l’anode s’écrit :
H2 (g) / H+ (aq) ; (faux ) ; H+ (aq) / H2 (g) (vrai ) ; H2 (g) / H2O (l) ( faux).
Pour la réaction de fonctionnement de la pile à hydrogène, le réducteur est :
Le dioxygène (faux) ; le dihydrogène ( vrai) ; l’eau ( faux).
La réaction qui a lieu à l’anode est :
une combustion (faux) ; une réduction (faux) ; une oxydation (vrai).
L’impact environnemental.
Comme
la production et le stockage du dihydrogène sont coûteux, on propose
que les besoins en chauffage soient compensés par une petite chaudière
à condensation. La consommation annuelle de propane de cette chaudière
s’élèverait à 1,3.105 mol de propane. Déterminer la quantité de matière de dioxyde de carbone qui serait produite en une année.
L’équation de la réaction chimique de la combustion du propane ayant lieu dans la chaudière s’écrit : C3H8 (g) + 5 O2 (g) ---> 3 CO2 (g) + 4 H2O (g).
En déduire la masse de dioxyde de carbone CO2 qui serait rejetée dans l’atmosphère.
Donnée Masse molaire moléculaire du dioxyde de carbone : M = 44,0 g.mol-1.
Quantité de matière de dioxyde de carbone : n = 3*1,3 105 = 3,9 105 mol.
masse de dioxyde de carbone : n M = 3,9 105 *44 =1,7 107 g = 17 tonnes.
Les
émissions de dioxyde de carbone ont un impact environnemental : elles
contribuent à l’augmentation de l’effet de serre. Indiquer un autre
impact environnemental. Acidification des océans.
Quel inconvénient présente la chaudière à condensation par rapport à la pile à hydrogène ?
La chaudière à condensation utilise un combustible fossile et contribue à l'effet de serre.
Valorisation du surplus d’énergie.
Une
partie du dihydrogène stocké sera utilisée pour subvenir aux besoins en
électricité du bâtiment à certains moments. On se propose d’utiliser le
surplus de dihydrogène, estimé à 8,4.104 mol, pour alimenter un véhicule électrique.
Une
telle acquisition serait rentable si la quantité de matière de
dihydrogène disponible était au moins égale à 70% des besoins du
véhicule.
Sachant que le véhicule envisagé devra parcourir 20 000 km
par an, est-il rentable de l’acquérir ? Vous expliquerez clairement les
étapes de votre démarche.
Données.
Le volume molaire d’un gaz est le volume occupé par une mole de ce gaz.
Volume molaire du dihydrogène dans les conditions de stockage : Vm = 3,5.10-2 L.mol-1.
Le volume de dihydrogène embarqué à bord d’une voiture est estimé à 150 L dans les conditions de stockage.
L’autonomie du véhicule est estimée à 500 km.
Volume de dihydrogène nécessaire pour parcourir 20 000 km :
150*20 000 / 500 = 6 103 L.
Quantité de matière correspondante : 6 103 / (3,5.10-2)=1,7 105 mol.
Pourcentage des besoins : 8,4.104 /(1,7 105) =0,49 ( 49 %). L'acquisition n'est pas rentable.
|
|
|